Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch H2SO4 loãng, dư thu được 4,48 lít khí (đktc) và thấy còn 8,8 gam chất rắn không tan. Lấy phần chất rắn không tan ra thu được 250ml dung dịch Y.
a) Xác định phần trăm về khối lượng các chất trong X.
b) Dung dịch Y tác dụng vừa đủ với BaCl2 thu được 69,9 gam kết tủa. Tính nồng độ mol các chất trong Y.
c) Nếu cho 12 gam X vào 300ml dung dịch AgNO3 0,8M. Sau một thời gian thu được 28 gam chất rắn Z. Tính khối lượng của Ag có trong Z.
 Giải bởi Vietjack
Giải bởi Vietjack
a) Khí thu được là H2 nên suy ra
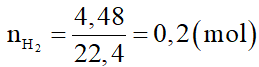
Trong X, chỉ có Fe tác dụng với dung dịch H2SO4 loãng theo phương trình hóa học:

Chất rắn không tan là Cu
mX = mFe + mCu = 11,2 + 8,8 = 20 (gam)
Phần trăm khối lượng các chất trong X là:
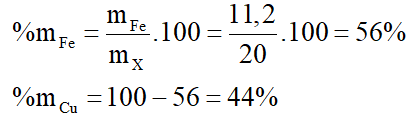
b) Dung dịch Y gồm FeSO4: 0,2 mol; H2SO4 dư: a mol.
Các phương trình hóa học:
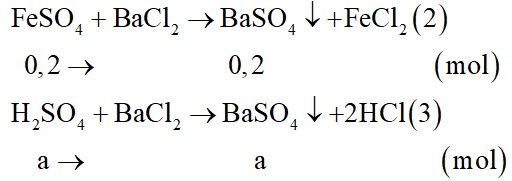
Kết tủa thu được là BaSO4
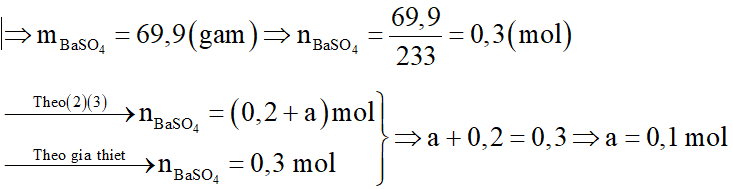
Nồng độ mol các chất trong Y là:
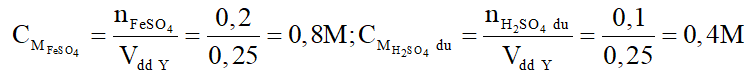
c) Số mol AgNO3 là:
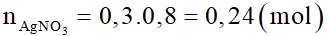
Số mol các chất trong 12 gam X là:
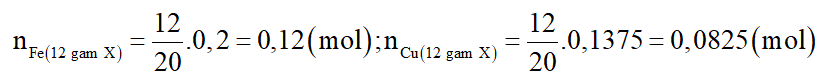
Fe là kim loại mạnh hơn Cu, do đó Fe phản ứng trước Cu.
Các phương trình hóa học có thể xảy ra:
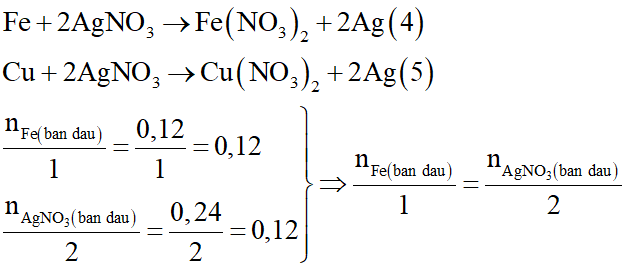
Vậy nếu phản ứng xảy ra hoàn toàn thì Fe và AgNO3 cũng phản ứng vừa đủ với nhau.
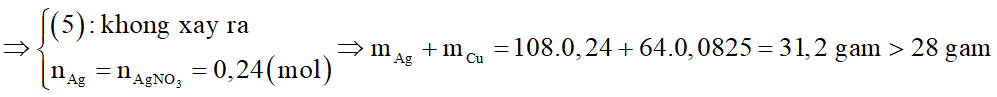
(vô lý)
Như vậy, phản ứng (4) xảy ra không hoàn toàn và phản ứng (5) không xảy ra.
Gọi số mol Fe phản ứng là x mol:
Phương trình hóa học:
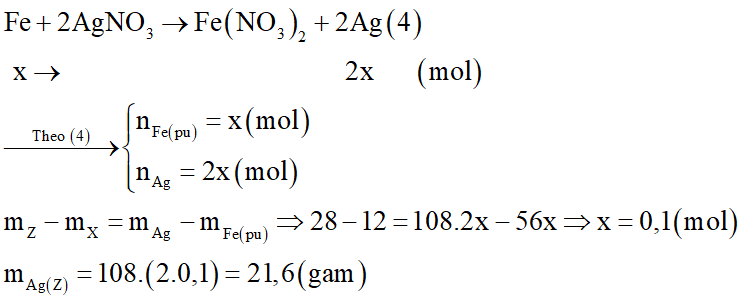
Bằng phương pháp hóa học nhận biết các dung dịch sau: NaOH, H2SO4, Na2SO4, HCl. Viết phương trình hóa học (nếu có).
Ngâm một lá Zn dư vào 200ml dung dịch AgNO3 1M. Khi phản ứng kết thúc khối lượng Ag thu được là:
Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với
Viết phương trình hóa học hoàn thành chuỗi biến hóa sau, ghi rõ điều kiện (nếu có)
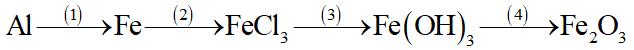
Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxit khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II.