Điện lượng (q) là một đại lượng đặc trưng cho lượng electron mà các điện cực trao đổi trong pin điện. Khi đó, điện lượng được xác định bởi biểu thức sau:
\({\rm{q}} = \) số mol electron \( \times {\rm{F}}\) (F là 1 mol điện lượng, \({\rm{F}} = 96485{\rm{C}}/{\rm{mol}}\)).
Một pin điện hoá được cấu tạo như sau:
Thanh kẽm \(({\rm{Zn}})\) nhúng vào 100 mL dung dịch \({\rm{ZnS}}{{\rm{O}}_4}0,1{\rm{M}}.\)
Thanh đồng \(({\rm{Cu}})\) nhúng vào 100 mL dung dịch \({\rm{CuS}}{{\rm{O}}_4}0,1{\rm{M}}.\)
Hai thanh kim loại được nối bằng dây dẫn với một thiết bị tiêu thụ điện và hai dung dịch nối với nhau bằng cầu muối. Phản ứng dừng lại khi \({\rm{C}}{{\rm{u}}^{2 + }}\) trong dung dịch bị khử hết thành Cu. Điện lượng (tính theo C) mà pin đó đã sản sinh là bao nhiêu?
(Làm tròn kết quả đến hàng đơn vị)
 Giải bởi Vietjack
Giải bởi Vietjack
Số \({\rm{molC}}{{\rm{u}}^{2 + }} = 0,1\;{\rm{mol}};{\rm{C}}{{\rm{u}}^{2 + }} + 2{\rm{e}} \to {\rm{Cu}}\)
\( \Rightarrow \) điện lượng mà pin sản \(\sinh = 0,02 \times {\rm{F}} = 1929,7{\rm{C}} = 1930{\rm{C}}\).
c. Phản ứng trong các pin nhiên liệu methanol-oxygen là phản ứng oxi hoá methanol bởi khí O2 thành fomaldehyde.
d. Sức điện động của pin không thay đổi cho đến khi phản ứng trong pin xảy ra hoàn toàn.
b. Sức điện động của pin ở 298 K là \(0,597\;{\rm{V}}\) và không đổi cho đến khi pin ngừng hoạt động.
Pin quả chanh được thiếp lập gồm một dây Cu và dây Zn ghim vào một quả chanh và nối với bóng điện như hình bên. Bóng điện sáng đồng nghĩa với sự xuất hiện dòng điện. Bán phản ứng nào sau đây xảy ra ở cực dương?

Phản ứng của acquy chì khi xả điện là:
Khi đó, Pb sẽ bị oxi hoá và tạo thành \({\rm{PbS}}{{\rm{O}}_4}\) bám vào điện cực và \({\rm{Pb}}{{\rm{O}}_2}\) bị khử thành \({\rm{PbS}}{{\rm{O}}_4}\) bám vào điện cực. Phát biểu nào sau đây đúng trong quá trình acquy xả điện?
Pin nhiên liệu đang được đặc biệt quan tâm nghiên cứu vì tiềm năng sử dụng trong tương lai do có nhiều ưu điểm so với pin Galvani hiện nay. Dòng điện tạo ra trong pin do phản ứng oxi hoá nhiên liệu \(\left( {{{\rm{H}}_2},{\rm{C}}{{\rm{H}}_3}{\rm{OH}},{\rm{C}}{{\rm{H}}_4}, \ldots } \right)\) bằng \({{\rm{O}}_2}\) của không khí. Ưu điểm của pin là sản sinh dòng điện với hiệu suất cao.
Cấu tạo và cơ chế hoạt động của pin nhiên liệu hydrogen như sau:
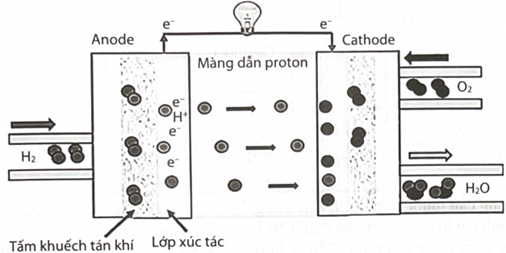
Phản ứng chung trong pin nhiên liệu hydrogen là
b. Các pin nhiên liệu hoạt động dựa trên các phản ứng oxi hoá hoàn toàn các nhiên liệu.
c. Cầu muối KCl có tác dụng trung hoà điện tích của hai dung dịch muối.
Phản ứng xảy ra khi sạc của một pin Li-ion là:
Để có được một pin điện có dung lượng là 4000 mAh thì khối lượng \({\rm{LiCo}}{{\rm{O}}_2}\) tối thiểu trước khi sạc là bao nhiêu?
Cho biết: \({{\rm{M}}_{{\rm{LiCo}}{{\rm{O}}_2}}} = 97,874\;{\rm{g}}/{\rm{mol}};1\;{\rm{mol}}\) điện lượng là 96485 C và \(1{\rm{C}} = 1\) A.s.
Cho biết sức điện động chuẩn của các pin sau:
|
Pin điện hoá |
X-Y |
M-Y |
M-Z |
|
Sức điện động chuẩn (V) |
0,20 |
0,60 |
0,30 |
Sự sắp xếp nào sau đây đúng với tính khử của các kim loại \({\rm{X}},{\rm{Y}},{\rm{Z}},{\rm{M}}\) ?
Phản ứng của acquy chì khi sạc điện là:
\(2{\rm{PbS}}{{\rm{O}}_4}(s) + 2{{\rm{H}}_2}{\rm{O}}(l) \to {\rm{Pb}}(s) + {\rm{Pb}}{{\rm{O}}_2}(s) + 2{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}(aq)\)
Chất được sinh ra ở cực âm khi acquy chì sạc điện là