Hòa tan 5,6 gam Fe bằng 250ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X có chứa chất tan T. Chất T có khả thể tác dụng với Na2CO3 tạo khí. Coi thể tích dung dịch thay đổi không đáng kể. Nồng độ mol của T là:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án A
; nHCl = 0,25.1 = 0,25 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2↑
Ban đầu 0,1 0,25 (mol)
PƯ 0,1 → 0,2 → 0,1 (mol)
Sau PƯ 0 0,05
Dd X thu được gồm: FeCl2: 0,1 mol và HCl dư 0,05 mol
Vì T phản ứng được với Na2CO3 sinh ra khí => T là HCl
=> CM HCl dư = nHCl : VHCl = 0,05 : 0,25 =0,2 (MCho phản ứng: Al + Cl2 …. Tổng hệ số tối giản của phương trình là:
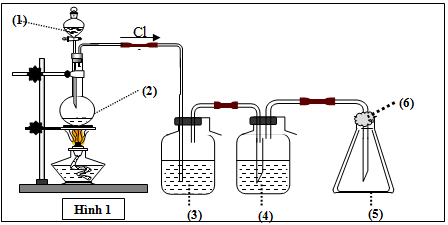
Mô hình điều chế khí clo trong phòng thí nghiệm được cho như hình vẽ bên (Hình 1). Quy trình thí nghiệm xảy ra như sau: Nhỏ từ từ dung dịch (1) xuống bình cầu có chứa chất rắn màu đen (2). Đun nóng hỗn hợp thì thoát ra khí clo (màu vàng lục). Khí clo sinh ra di chuyển theo hệ thống bình (3); (4); (5). Tại bình số (5), khí clo được giữ lại. Để tránh việc clo thoát ra ngoài không khí, người ta tẩm vào (6) dung dịch T. Vậy (1) là:
Nhúng một thanh sắt vào dung dịch đồng (II) sunfat. Phản ứng hóa học xảy ra là:
Điện trở đặc trưng cho khả năng cản trở dòng điện. Điện trở càng lớn thì khả năng dẫn điện của kim loại càng giảm. Cho 4 kim loại X, Y, Z, T ngẫu nhiên tương ứng với Ag, Al, Fe, Cu. Cho bảng giá trị điện trở của các kim loại sau:
|
Kim loại |
X |
Y |
Z |
T |
|
Điện trở |
|
|
|
|
X là kim loại:
Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là:
Cho phản ứng hóa học: x… + H2SO4 → FeSO4 + y… . Tổng (x + y) có thể là:
Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là: