Bộ 30 đề thi học kì 1 Hóa 9 có đáp án_ đề 16
-
4253 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Công thức hóa học của nhôm là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Học thuộc tên và kí hiệu hóa học tương ứng của kim loại
Giải chi tiết:
CTHH của nhôm là Al
Câu 2:
Công thức hóa học của axit sunfuric là:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Học thuộc tên và kí hiệu hóa học tương ứng của axit
Giải chi tiết:
CTHH của axit sunfuric là: H2SO4
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Học thuộc tên gọi tương ứng của các oxit, hiđroxit (sgk hóa 8 trang 89)
Giải chi tiết:
Al2O3: nhôm oxit
Al(OH)3: nhôm hiđroxit
Câu 4:
Sản phẩm khi đốt cháy nhôm trong khí oxi (O2) là:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Nhôm + oxi → Nhôm oxit
Giải chi tiết:
4Al + 3O2 2Al2O3
Câu 5:
Cho phản ứng: Al + Cl2 …. Tổng hệ số tối giản của phương trình là:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Viết phương trình phản ứng, cân bằng phương trình theo phương pháp chẵn lẻ
aAl + bCl2 cAlCl3
=> tổng hệ số tối giản của phương trình là: a+b+c
Giải chi tiết:
4Al + 3Cl2 2AlCl3
Tổng hệ số tối giản = 4 + 3 + 2 = 9
Câu 6:
Nhôm không tác dụng được với:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất hóa học của Al
+ Tác dụng với dd axit, dd bazo
+ Tác dụng với dd muối của kim loại đứng sau nó trong dãy điện hóa
Giải chi tiết:
Al không phản ứng được với NaCl
Câu 7:
Nhúng một thanh sắt vào dung dịch đồng (II) sunfat. Phản ứng hóa học xảy ra là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại: Từ Mg trở về sau trong dãy điện hóa, kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch muối của chúng
Giải chi tiết:
Phản ứng hóa học xảy ra là: Fe + CuSO4 FeSO4 + Cu.↓
Câu 8:
Nhiệt phân sắt (III) hidroxit thu được sản phẩm là:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Bazo không tan nhiệt phân tạo thành oxit tương ứng và nước
Giải chi tiết:
2Fe(OH)3 Fe2O3 + 3H2O
Câu 9:
Thêm vài giọt kali hidroxit vào dung dịch đồng (II) clorua. Sản phẩm thu được là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dd bazo + dd muối → muối mới + bazo mới (điều kiện có chất kết tủa hoặc bay hơi)
Giải chi tiết:
2KOH + CuCl2 → Cu(OH)2↓ + 2KCl
Câu 10:
Cho phản ứng hóa học: x… + H2SO4 → FeSO4 + y… . Tổng (x + y) có thể là:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Thấy sản phẩm có xuất hiện nguyên tố Fe => chất ban đầu có thể Fe hoặc các hợp chất của Fe
Nhưng chất phản ứng được với H2SO4 sinh ra khí thì chỉ có Fe
Từ đó viết PTHH và xác định được x, y =?
Giải chi tiết:
Fe + H2SO4 → FeSO4 + H2↑
=> Tổng (x+y) = 1+1 = 2
Câu 11:
Phản ứng hóa học nào sau đây không chính xác:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại: Từ Mg trở về sau trong dãy điện hóa, kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch muối của chúng
Giải chi tiết:
Phản ứng C sai vì Cu là kim loại đứng sau Mg trong dãy điện hóa, nên Cu không thể đẩy được Mg ra khỏi muối MgSO4
Câu 12:
Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Giải chi tiết:
Hiện tượng: xuất hiện kết tủa trắng
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Ghi nhớ sự đổi màu của quỳ tím trong các môi trường axit, bazo. Từ đó xác định được NaOH có môi trường gì => sự đổi màu của quỳ tím
Giải chi tiết:
Dd NaOH làm quỳ tím chuyển sang màu xanh
Câu 14:
Có thể phân biệt Fe và Al bằng dung dịch:
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào tính chất hóa học khác nhau của Al và Fe
Al thì có phản ứng với dd kiềm còn Fe thì không có phản ứng => dùng dd kiềm để nhận biết
Giải chi tiết:
Al tác dụng được với dd NaOH còn Fe thì không => dùng dd NaOH để phân biệt
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Câu 15:
Có thể phân biệt BaCl2 và NaCl bằng dung dịch:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Ta thấy đây là 2 muối của Cl- => chọn thuốc thử dựa vào dấu hiệu nhận biết cation Ba2+ và Na+.
Mà ion Na+ thì không có thuốc thử đặc trưng để nhận biết => chọn thuốc thử đặc trưng nhận biết Ba2+
Giải chi tiết:
Dùng H2SO4 để phân biệt BaCl2 và NaCl
+ BaCl2 tạo kết tủa trắng, còn NaCl thì không có hiện tượng gì
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Ghi nhớ phản ứng điều chế Al trong công nghiệp
Giải chi tiết:
Thành phần chính của quặng boxit là Al2O3
Thành phần chính của quặng Pirit là FeS2
Thành phần chính của quặng Dolomit là: MgCO3. CaCO3
Thành phần chính của quặng Apatit là: Ca3(PO4)2
Câu 17:
Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
HCl chỉ tác dụng được với các kim loại đứng trước H trong dãy điện hóa của kim loại
Giải chi tiết:
Cu là kim loại đứng sau H trong dãy điện hóa nên không tan trong dd HCl => chất rắn T là Cu
Câu 18:
Khí X là nguyên nhân gây hiệu ứng nhà kính, đồng thời khí X cũng một nguyên nhân gây mưa axit. Vậy công thức hóa học của X là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức hiểu biết thực tế
Giải chi tiết:
CO2 là nguyên nhân chính gây nên hiệu ứng nhà kính
Câu 19:
Ăn mòn kim loại do ma sát được gọi là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức về ăn mòn kim loại
Giải chi tiết:
Ăn mòn kim loại do ma sát không làm thay đổi tính chất hóa học của kim loại => là ăn mòn vật lí
Câu 20:
Kim loại có nhiệt độ nóng chảy thấp nhất là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức về kim loại
Giải chi tiết:
Hg là kim loại duy nhất ở điều kiện thường ở thể lỏng => có nhiệt độ nóng chảy thấp nhất
Câu 21:
Mô hình điều chế khí clo trong phòng thí nghiệm được cho như hình vẽ bên (Hình 1). Quy trình thí nghiệm xảy ra như sau: Nhỏ từ từ dung dịch (1) xuống bình cầu có chứa chất rắn màu đen (2). Đun nóng hỗn hợp thì thoát ra khí clo (màu vàng lục). Khí clo sinh ra di chuyển theo hệ thống bình (3); (4); (5). Tại bình số (5), khí clo được giữ lại. Để tránh việc clo thoát ra ngoài không khí, người ta tẩm vào (6) dung dịch T. Vậy (1) là:
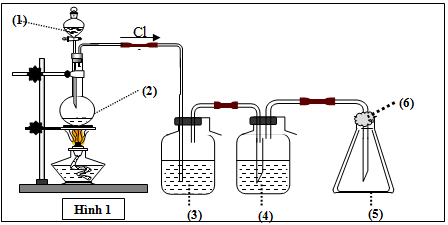
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Chọn chất có phản ứng được với Cl2 thì mới giữ Cl2 lại được, tránh thoát ra ngoài không khí
Giải chi tiết:
Để tránh Cl2 thoát ra ngoài không khí, người ta tẩm NaOH vào (6). Vì Cl2 có phản ứng với NaOH do đó bị giữ lại
PTPƯ: Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 22:
Kim loại có nhiệt độ nóng chảy thấp nhất là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức về kim loại
Giải chi tiết:
Hg là kim loại duy nhất ở điều kiện thường ở thể lỏng => có nhiệt độ nóng chảy thấp nhất
Câu 23:
Hòa tan hoàn toàn 5,6 gam Fe bằng dung dịch HCl, sau phản ứng thu được V lít H2 (đktc). Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án B
PTPƯ: Fe + 2HCl → FeCl2 + H2↑
0,1 → 0,1 (mol)
=> VH2(đktc) = 0,1×22,4 = 2,24 (lít)
Câu 24:
Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án B
PTPƯ: FeO + 2HCl → FeCl2 + H2O
0,2 → 0,4 (mol)
VHCl = nHCl : CM = 0,4 : 2 = 0,2 (lít) = 200 (ml)
Câu 25:
Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số mol của CuSO4 phản ứng là x (mol)
PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
x ← x → x (mol)
Khối lượng tăng: mtăng = mCu - mFe
=> 1,6 = 64x – 56x
=> 1,6 = 8x
=> x = 0,2 (mol)
Câu 26:
Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án B
Đặt số mol Al = số mol Fe = x (mol)
PTHH:
2Al + 6HCl → 2AlCl3 + 3H2↑
x → 1,5x (mol)
Fe + 2HCl → FeCl2 + H2↑
x → x (mol)
Tổng số mol H2 là: 1,5x + x = 0,25 => x = 0,1 (mol)
=> mhh = mAl + mFe = 0,1.27 + 0,1.56 = 8,3
Câu 27:
Để trung hòa hoàn toàn 100ml dung dịch NaOH 1M cần vừa đủ V ml dung dịch H2SO4 2M. Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án A
nNaOH = 0,1.1 = 0,1 (mol)
PTPƯ: 2NaOH + H2SO4 → Na2SO4 + H2O
0,1 → 0,05 (mol)
=> VH2SO4 = nH2SO4 : CM = 0,05 : 2 = 0,025 (lít) = 25 (ml)
Câu 28:
Điện trở đặc trưng cho khả năng cản trở dòng điện. Điện trở càng lớn thì khả năng dẫn điện của kim loại càng giảm. Cho 4 kim loại X, Y, Z, T ngẫu nhiên tương ứng với Ag, Al, Fe, Cu. Cho bảng giá trị điện trở của các kim loại sau:
|
Kim loại |
X |
Y |
Z |
T |
|
Điện trở |
|
|
|
|
X là kim loại:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Kim loại X có điện trở lớn nhất => trong 4 kim loại X có tính dẫn điện thấp nhất => X =?
Giải chi tiết:
Điện trở càng lớn thì khả năng dẫn điện càng giảm
Kim loại X có điện trở lớn nhất => trong 4 kim loại X có tính dẫn điện thấp nhất => X là kim loại Fe
Câu 29:
Hòa tan 5,6 gam Fe bằng 250ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X có chứa chất tan T. Chất T có khả thể tác dụng với Na2CO3 tạo khí. Coi thể tích dung dịch thay đổi không đáng kể. Nồng độ mol của T là:
 Xem đáp án
Xem đáp án
Đáp án A
; nHCl = 0,25.1 = 0,25 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2↑
Ban đầu 0,1 0,25 (mol)
PƯ 0,1 → 0,2 → 0,1 (mol)
Sau PƯ 0 0,05
Dd X thu được gồm: FeCl2: 0,1 mol và HCl dư 0,05 mol
Vì T phản ứng được với Na2CO3 sinh ra khí => T là HCl
=> CM HCl dư = nHCl : VHCl = 0,05 : 0,25 =0,2 (MCâu 30:
 Xem đáp án
Xem đáp án
Đặt số mol R = 1 (mol)
PTPƯ: R + H2SO4 → RSO4 + H2↑
1 →1 →1 →1 (mol)
mH2SO4 = nH2SO4. MH2SO4 = 1.98 = 98 (g)
Khối lượng dung dịch sau là:
mdd sau = mR + mddH2SO4 – mH2 = R + 1000 – 1.2
=> mdd sau = R + 9998 (g)
Muối Y là: RSO4: 1 (mol) => mRSO4 = (R +96) g
Nồng độ phần trăm của muối Y là:
