Bộ 30 đề thi học kì 1 Hóa 9 có đáp án_ đề 23
-
4252 lượt thi
-
12 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Oxit nào sau đây phản ứng với nước ở điều kiện thường?
 Xem đáp án
Xem đáp án
Đáp án C
Các oxit bazo của kim loại kiềm và kiềm thổ (trừ BeO, MgO) tác dụng được với nước ở điều kiện thường.
Na2O + H2O → 2NaOH
Câu 2:
Dung dịch HCl không tác dụng với chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Ag là kim loại đứng sau H trong dãy điện hóa nên không tác dụng được với HCl
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án D
Đất chua là đất có môi trường axit => dùng hóa chất có tính bazo để trung hòa bớt độ chua của đất
CaO + H2O → Ca(OH)2 (môi trường bazo)
Ca(OH)2 trung hòa lượng H+ trong đất làm đất bớt chua
Câu 4:
Hòa tan hoàn toàn 5,6 gam Fe cần dùng V(ml) dung dịch HCl 2M. Giá trị của V cần tìm là:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
nFe = 5,6: 56 = 0,1 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2↑
Theo PTHH: nHCl = 2nFe = ? (mol)
=> VHCl = n: CM = ? (lít) = ? (ml)
Giải chi tiết:
nFe = 5,6: 56 = 0,1 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2↑
Theo PTHH: nHCl = 2nFe = 2. 0,1 = 0,2 (mol)
=> VHCl = n: CM = 0,2: 2 = 0,1 (lít) = 100 (ml)
Câu 6:
Cặp chất nào sau đây cùng tồn tại trong một dung dịch?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
2 chất không tác dụng được với nhau sẽ cùng tồn tại được trong một dung dịch
Giải chi tiết:
2 chất không tác dụng được với nhau sẽ cùng tồn tại được trong một dung dịch
A. thỏa mãn
B. H2SO4 + 2KOH → K2SO4 + 2H2O
C. BaCl2 + H2SO4 → BaSO4↓ +2HCl
D. NaCl + AgNO3→ AgCl↓ + NaNO3
Câu 7:
Bazơ nào sau đây không bị phân hủy bởi nhiệt?
 Xem đáp án
Xem đáp án
Đáp án C
NaOH là bazo tan nên không bị nhiệt phân hủy
Các bazo không tan còn lại bị nhiệt phân tạo thành oxit bazo và nước
Câu 8:
Dãy nguyên tố nào sau đây xếp theo chiều tăng dần tính kim loại?
 Xem đáp án
Xem đáp án
Đáp án A
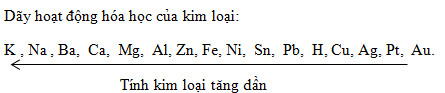
Thứ tự tính kim loại tăng dần là: Fe, Zn, Al, Mg, Na.
Câu 10:
Chỉ dùng quỳ tím hãy nhận biết các dung dịch riêng biệt đựng trong các lọ mất nhãn sau: HCl, Na2SO4, Ba(OH)2, NaCl. Viết các phương trình phản ứng xảy ra
 Xem đáp án
Xem đáp án
Trích mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
- Cho lần lượt quỳ tím vào các ống nghiệm:
+ ống nghiệm quỳ tím chuyển sang màu đỏ là: HCl
+ ống nghiệm quỳ tím chuyển sang màu xanh là: Ba(OH)2
+ ống nghiệm làm quỳ tím không chuyển màu là: Na2SO4, NaCl (dãy I)
- Dùng Ba(OH)2 đã nhận biết được cho lần lượt vào các ống nghiệm ở dãy (I)
+ ống nghiệm nào xuất hiện kết tủa trắng là Na2SO4
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
+ ống nghiệm còn lại không có hiện tượng gì là NaCl.
Câu 11:
Hòa tan hoàn toàn 13,6 gam hỗn hợp bột gồm MgO và Fe cần dùng V(ml) dung dịch HCl 2,5M. Sau phản ứng thu được 2,24 lít khí hiđro ở đktc.
a. viết phương trình phản ứng xảy ra.
b. tính khối lượng của mỗi chất trong hỗn hợp ban đầu.
c. tính thể tích dung dịch HCl 2,5M đã dùng.
 Xem đáp án
Xem đáp án
a. PTHH
MgO + 2HCl → MgCl2 + H2O (1)
Fe + 2HCl → FeCl2 + H2↑ (2)
b.
Theo PTHH (2): nFe = nH2 = 0,1 (mol)
Khối lượng Fe là: mFe = 0,1. 56 = 5,6 (g)
Khối lượng MgO là: mMgO = 13,6 – mFe = 13,6 – 5,6 = 8 (g)
c.
Số mol của MgO là:
Theo PTHH (1): nHCl(1) = 2nMgO = 2.0,2 = 0,4 (mol)
Theo PTHH (2): nHCl (2) = 2nH2 = 2. 0,1 = 0,2 (mol)
Tổng số mol HCl là: ∑ nHCl = nHCl(1) + nHCl(2) = 0,4 + 0,2 = 0,6 (mol)
Thể tích dung dịch HCl 2,5M đã dùng là: VHCl = ∑ nHCl : CM = 0,6 : 2,5 = 0,24(lít) = 240 (ml)
Câu 12:
Cô cạn từ từ 200ml dung dịch CuSO4 0,2M thu được 10 gam tinh thể CuSO4.xH2O. Tìm x ?
 Xem đáp án
Xem đáp án
200 ml = 0,2 (lít)
nCuSO4 = CM. V = 0,2. 0,2 = 0,04 (mol)
Vì cô cạn chỉ là quá trình làm bay hơi nước, khối lượng CuSO4 trước và sau khi cô cạn không thay đổi.
Số mol CuSO4 trước và sau cô cạn bằng nhau.
nCuSO4.xH2O = nCuSO4 = 0,04 (mol)
=> khối lượng phân tử của CuSO4.xH2O là:
Ta có: 160 + 18x = 250
=> 18x = 90
=> x = 90: 18
=> x = 5
