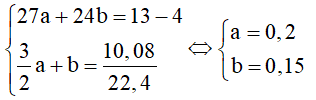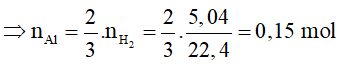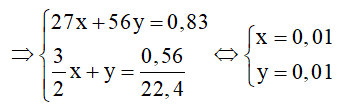Bài tập Hỗn hợp kim loại tác dụng với axit chọn lọc, có đáp án
-
1259 lượt thi
-
10 câu hỏi
-
10 phút
Danh sách câu hỏi
Câu 1:
Hòa tan 13,2g hỗn hợp X gồm hai kim loại có cùng hóa trị vào 200ml dung dịch HCl 3M. Cô cạn dung dịch sau phản ứng thu được 23,85g hỗn hợp muối khan. Tính thể tích hiđro sinh ra.
 Xem đáp án
Xem đáp án
= 23,85 - 13,2 = 10,65g
⇒ = 10,65/35,5 = 0,3 mol
⇒ = 1/2 nCl- = 0,15 mol
⇒ V = 0,15.22,4 = 3,36 lit
⇒ Chọn B.
Câu 2:
Hòa tan hết 11,2g hỗn hợp gồm hai kim loại X (hóa trị x) và Y (hóa trị y) trong dung dịch HCl rồi sau đó cô cạn dung dịch thu được 39,6g muối khan. Tính thể tích khí hidro sinh ra là?
 Xem đáp án
Xem đáp án
⇒ Chọn A.
Câu 3:
Thí nghiệm 1: cho a gam Fe hòa tan trong dung dịch HCl, sau khi cô cạn dung dịch thu được 3,1 gam chất rắn.
Thí nghiệm 2: cho a gam Fe và b gam Mg vào dung dịch HCl (cùng với lượng như trên) sau khi cô cạn dung dịch thì thu được 3,34g chất rắn và 448ml .Tính a, b.
 Xem đáp án
Xem đáp án
Đáp án C
Câu 4:
Cho 13g hỗn hợp A gồm Cu, Al, Mg vào dung dịch HCl dư, phản ứng xong thu được 4 gam chất rắn không tan và 10,08 lít khí (đktc). Tính thành phần phần trăm theo khối lượng của từng kim loại trong hỗn hợp.
 Xem đáp án
Xem đáp án
2Al + 6HCl → 2 + 3
a……….3/2.a (mol)
Mg + 2HCl → +
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
⇒ Chọn C.
Câu 5:
Lấy 20,05 gam hỗn hợp Al + cho tác dụng với axit sunfuric loãng, dư thì có 5,04 lít khí sinh ra. Trộn 20,05g hỗn hợp đầu trong bình kín rồi nung nóng để thực hiện phản ứng nhiệt nhôm. (Thể tích khí đo ở đktc). Tính khối lượng của có trong hỗn hợp trước và sau phản ứng nhiệt nhôm.
 Xem đáp án
Xem đáp án
⇒ (bđ) = 20,05 - 0,15.27 = 16g
⇒ (bđ) = 16/160 = 0,1 mol
2Al + → + 2Fe
Bđ: 015 0,1
Pư: 0,15 0,065
Dư: 0 0,025
⇒ (dư) = 0,025.160=4g
⇒ Chọn A.
Câu 6:
Cho 10,5g hỗn hợp 2 kim loại Cu, Zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Tính khối lượng chất rắn còn lại sau phản ứng.
 Xem đáp án
Xem đáp án
Cu không tác dụng với axit Sunfuric.
⇒ = = 2,24/22,4 = 0,1 mol
⇒ = 0,1.65 = 6,5g
⇒ = = 10,5 - 6,5 =4g
⇒ Chọn B.
Câu 7:
Cho 0,83g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch loãng dư, người ta thu được 0,56 lít khí (đktc). Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu.
 Xem đáp án
Xem đáp án
x 3/2 x mol
y y mol
⇒ Chọn D.
Câu 8:
A là hỗn hợp gồm: Ba, Al, Mg. Lấy m gam A cho tác dụng với nước tới khi hết phản ứng thấy thoát ra 3,36 lit (đktc). Lấy m gam A cho vào dung dịch xút dư tới khi hết phản ứng thấy thoát ra 6,72 lít (đktc). Lấy m gam A hoà tan bằng một lượng vừa đủ dung dịch axit HCl thì thu được một dung dịch và 8,96 lit (đktc). Hãy tính m gam.
 Xem đáp án
Xem đáp án
Gọi số mol của Ba, Al và Mg lần lượt là x, y và z mol
Lượng khí thu được khi cho A vào nước dư ít hơn khi cho A vào xút dư nên khi cho A vào nước dư thì Ba phản ứng hết, Al phản ứng một phần. Khi cho A vào xút dư thì cả Ba và Al đều phản ứng hết.
Cho A tác dụng với nước dư có phản ứng:
Khối lượng của A là: m = 0,0375.137 + 0,175.27 + 0,1.24 = 12,2625 gam.
⇒ Chọn B
Câu 9:
Hoà tan hoàn toàn 3,9 gam hỗn hợp gồm Mg và kim loại R có tỉ lệ mol tương ứng là 1:2 cần 200 ml dung dịch HCl 2M. Kim loại R và thành phần % khối lượng của nó trong hỗn hợp là
 Xem đáp án
Xem đáp án
⇒ Chọn D.
Câu 10:
Hoà tan 5,2g hỗn hợp gồm Mg và Fe bằng dung dịch axit HCl 1M, thì thu được 3,36 lit (đktc). Tính thể tích dung dịch axit HCl đã dùng.
 Xem đáp án
Xem đáp án
Gọi số mol của Mg và Fe lần lượt là x và y mol
Khối lượng hỗn hợp là 5,2 gam → 24x + 56y = 5,2 (1)
Phương trình hóa học:
⇒ Chọn B.