Trắc nghiệm chuyên đề Hóa 9 Chủ đề 6: Kim loại tác dụng với nước (có đáp án)
Trắc nghiệm chuyên Đề Hóa 9 Chủ đề 6;Kim loại tác dụng với nước (có đáp án)
-
1182 lượt thi
-
10 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho 1,24 g hỗn hợp Na và K tác dụng hết với nước, sau phản ứng thu được 1,92 gam hỗn hợp 2 bazơ NaOH và KOH. Thể tích khí H2 sinh ra ở đktc là:
 Xem đáp án
Xem đáp án
2Na + 2H2O → 2NaOH + H2
x…………………x……x/2…….mol
2K + 2H2O → 2KOH + H2
y…………………y……..y/2………..mol
Theo bài ra, ta có hệ phương trình:

⇒ nH2 = x/2 + y/2 = 0,1+ 0,1 = 0,02 mol
⇒ VH2 = 0,02.22,4=0,448 mol
⇒ Chọn D.
Câu 2:
Cho hỗn hợp X gồm 2 kim loại kiềm tan hết trong nước tạo ra dung dịch Y và thoát ra 0,12 mol H2. Thể tích dung dịch H2SO4 2M cần trung hòa dung dịch Y là:
 Xem đáp án
Xem đáp án
Quy đổi 2 kim loại kiềm là 1 kim loại trung bình M. Khi đó:
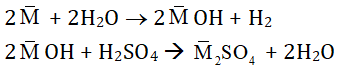
Ta thấy:
nMOH = 2nH2 = 2.0,12 = 0,24 mol
⇒ nH2SO4 = 1/2 nMOH = 1/2 . 0,24 = 0,12 mol
⇒ VH2SO4 = 0,12/2 = 0,06 lit = 60ml
⇒ Chọn B.
Câu 3:
Cho 8,5g hỗn hợp Na và K tác dụng với nước thu được 3,36l khí hidro (đktc) và dung dịch X. Cho X tác dụng vừa đủ với dung dịch Fe2(SO4)3 thu được m(g) kết tủa. Giá trị của m là:
 Xem đáp án
Xem đáp án
Quy đổi 2 kim loại kiềm Na và K là 1 kim loại trung bình . Khi đó:
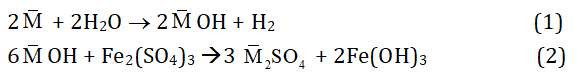
Theo bài ta có:
nH2 = 3,36/22,4 = 0,15 mol
⇒ nMOH = 2nH2 = 2.0,15 = 0,3 mol
⇒ nFe(OH)3 = 1/3 nMOH = 1/3.0,3 = 0,1 mol
⇒ m↓ = mFe(OH)3 = 0,1.107 = 10,7 g
⇒ Chọn C.
Câu 4:
Cho 0,6 gam hỗn hợp gồm hai kim loại ở 2 chu kỳ liên tiếp thuộc nhóm IA tác dụng hết với H2O (dư), thoát ra 0,672 lít khí H2 (ở đktc). Hai kim loại đó là: (cho Li = 7, Na= 23, K = 39; Ca = 40)
 Xem đáp án
Xem đáp án
Tương tự bài 2(Bài tập mẫu)
⇒ Chọn A.
Câu 5:
Cho 1,77 g hỗn hợp Ca và Ba tác dụng hết với nước, sau phản ứng thu được 2,45g hỗn hợp 2 bazơ Ca(OH)2 và Ba(OH)2. Thể tích khí H2 sinh ra ở đktc là:
 Xem đáp án
Xem đáp án
Ca + 2H2O → Ca(OH)2 + H2
x………………...x……………x……….mol
Ba + 2H2O → Ba(OH)2 + H2
y………………y…………..y…………mol
Giải hệ phương trình:

⇒ nH2 = x+y = 0,02 mol
⇒ VH2 = 0,02.22,4 = 0,448 lit
⇒ Chọn B.
Câu 6:
Cho 0,85 g hỗn hợp 2 kim loại Na và K tác dụng hết với nước, sau phản ứng thu được 0,336 lít khí H2 (đktc). Tổng khối lượng hiđroxit sinh ra là:
 Xem đáp án
Xem đáp án
Tương tự bài 1.
Chọn A.
Câu 7:
Cho một hỗn hợp kim loại Na-Ba tác dụng với nước dư, thu được dung dịch X và 3,36l H2 (đktc). Thể tích dung dịch axit HCl 2M cần dùng để trung hòa dung dịch X là:
 Xem đáp án
Xem đáp án
2Na + 2H2O → 2NaOH + H2
Ba + 2H2O → Ba(OH)2 + H2
Từ 2 phương trình trên ta có nhận xét:
nOH- = 2nH2 = 2.33,6/22,4 = 0,15 mol
Mà: OH- + H+ → H2O
⇒ nOH- = nH+ = 0,15 mol = nHCl
⇒ VHCl = 0,15/2 = 0,075 lit = 75ml
⇒ Chọn B.
Câu 8:
Cho hỗn hợp Na, K, Ba tác dụng hết với nước, thu được dung dịch X và 6,72l khí H2 (đktc). Nếu cho X tác dụng hết với dung dịch Al(NO3)3 thì khối lượng kết tủa lớn nhất thu được là:
 Xem đáp án
Xem đáp án
Từ nhận xét của bài 7 ta có:
nOH- = 2nH2 = 2.6,72/22,4 = 0,6 mol
Cho X tác dụng với Al(NO3)3, đạt kết tủa lớn nhất khi Al(OH)3 tạo ra chưa bị hòa tan bởi các hidroxit kiềm, kiềm thổ trong X, khi đó:
Al3+ + 3OH- → Al(OH)3
⇒ nAl(OH)3 = 1/3 nOH- = 1/3 . 0,6 = 0,2 mol
⇒ m↓ = mAl(OH)3 = 0,2.78 = 15,6g
⇒ Chọn B.
Câu 10:
Cho Bari vào nước được dung dịch A. Cho lượng dư dung dịch Na2CO3 và dung dịch A rồi dẫn tiếp luồng khí CO2 vào đến dư. Hiện tượng nào đúng trong số các hiện tượng sau
 Xem đáp án
Xem đáp án
Giải thích bằng PTHH:
Ba + 2H2O → Ba(OH)2 + H2
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH
BaCO3 + CO2 + H2O → Ba(HCO3)2
Hiện tượng: Bari tan, sủi bọt khí, sau đó tạo kết tủa, cuối cùng kết tủa tan dần.
⇒ Chọn D.
