Đốt cháy m gam hỗn hợp X gồm Zn, Al, Mg và Fe trong bình chứa 0,1 mol O2, thu được hỗn hợp Y. Hòa tan toàn bộ Y trong dung dịch HCl dư, thu được 0,15 mol H2 và dung dịch chứa 38,05 gam muối. Giá trị của m là
 Giải bởi Vietjack
Giải bởi Vietjack
Bảo toàn điện tích → nCl- (muối) = ne = 4nO2 + 2nH2 = 0,7
→ mX = m muối – mCl = 13,2 gam
Chọn C
Cho sơ đồ chuyển hóa:
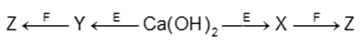
Biết: X, Y, Z, E, F là các hợp chất khác nhau; mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E, F thỏa mãn sơ đồ trên lần lượt là
Butan là một trong hai thành phần chính của khí đốt hóa lỏng (Liquified Petroleum Gas-viết tắt là LPG). Khi đốt cháy 1 mol butan tỏa ra lượng nhiệt là 2497 kJ. Để thực hiện việc đun nóng 1 gam nước tăng thêm 1°C cần cung cấp nhiệt lượng là 4,18J. Khối lượng butan cần đốt để đưa 2 lít nước từ 25°C lên 100°C. Biết rằng khối lượng riêng của nước là 1 g/ml và hiệu suất nhiệt lượng tỏa ra khi đốt cháy butan dùng để nâng nhiệt độ của nước là 60%
Tiến hành điện phân dung dịch X chứa m gam hỗn hợp gồm CuSO4 và NaCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A. Quá trình điện phân được ghi nhận như sau:
+ Sau thời gian t giây thu được dung dịch Y; đồng thời ở anot thoát ra V lít khí (đktc). Cho dung dịch H2S dư vào Y, thu được 9,6 gam kết tủa. Nếu nhúng thanh Fe vào Y, kết thúc phản ứng, thấy khối lượng Fe giảm 2,0 gam so với ban đầu.
+ Sau thời gian 2t giây, tổng thể tích khí thoát ra ở hai điện cực là 4,48 lít (đktc).
Các khí sinh ra không tan trong dung dịch và quá trình điện phân đạt hiệu suất 100%. Cho các nhận định sau:
(a) Giá trị của t là 5404.
(b) Nếu thời gian điện phân là 3088 giây thì nước bắt đầu điện phân ở anot.
(c) Giá trị của m là 46,16.
(d) Giá trị của V là 2,24.
Số nhận định đúng là:
α-aminoaxit X chứa một nhóm -NH2. Cho 10,3 gam X tác dụng với axit HCl (dư), thu được 13,95 gam muối khan. Công thức cấu tạo thu gọn của X là
Hòa tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là:
Cho ba hợp chất hữu cơ mạch hở E (C4H8O4), F (C4H6O4) và G (C5H8O5). Thực hiện sơ đồ chuyển hóa sau:
E + KOH → X + Y
F + KOH → X + Z + T
G + KOH → X + T
X + HCl → Q + KCl
Biết X, Y, Z, T là các hợp chất hữu cơ; Y và T chứa cùng một loại nhóm chức và hơn kém nhau một nguyên tử cacbon. Cho các nhận định sau:
(a) Chất G có hai công thức cấu tạo thỏa mãn.
(b) Phần trăm khối lượng oxi trong chất Q bằng 63,16%.
(c) Trong công nghiệp, chất Y được điều chế từ chất béo.
(d) Axit axetic được điều chế trực tiếp từ chất T.
(e) E, F và G đều tham gia phản ứng tráng bạc.
Số phát biểu đúng là
Các núi đá dọc bờ sông hay ở dưới biển thì có hiện tượng chân núi đá bị ăn mòn lõm vào tạo hốc sâu, hang động… Ngoài tác động mài mòn của nước thì có nguyên nhân chính là có phản ứng hóa học xảy ra trong thời gian dài. Phản ứng đó là
Cho một mẫu quặng photphorit X (chứa 88,35% khối lượng Ca3(PO4)2, còn lại là tạp chất trơ không chứa photpho) tác dụng với dung dịch H2SO4 đặc (vừa đủ). Sau phản ứng hoàn toàn, làm khô hỗn hợp, thu được supephotphat đơn Y. Độ dinh dưỡng của Y là
Hỗn hợp E gồm hai axit oleic, axit panmitic và chất béo Y (có tỉ lệ mol nAxit : nY = 5 : 4). Cho E vào dung dịch NaOH dư (đun nóng), sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch Z. Cô cạn dung dịch Z thu được chất rắn T có khối lượng 53,06 gam chứa 3 chất rắn khan. Đốt cháy hoàn toàn T thu được Na2CO3; 2,795 mol CO2 và 2,775 mol H2O. Phần trăm khối lượng của Y trong E có giá trị gần nhất với giá trị nào sau đây?
Cho vào ống nghiệm một vài tinh thể K2Cr2O7, sau đó thêm tiếp khoảng 1 ml nước và lắc đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch KOH vào dung dịch X, thu được dung dịch Y. Màu sắc của dung dịch X và Y lần lượt là
Cho các phát biểu sau:
(a) Tơ nitron được điều chế bằng phản ứng trùng ngưng.
(b) Ở điều kiện thường, alanin là chất rắn.
(c) Ở điều kiện thích hợp, tripanmitin tham gia phản ứng cộng H2.
(d) Thủy phân saccarozơ trong môi trường kiềm thu được glucozơ và fructozơ.
(e) Thủy tinh hữu cơ khi vỡ tạo ra các hạt tròn không có cạnh sắc.
(g) Lưu hóa cao su buna bằng lưu huỳnh, thu được cao su buna-S.
Số phát biểu sai là:
Dung dịch glucozơ (C6H12O6) 5%, có khối lượng riêng là 1,02 g/ml, phản ứng oxi hoá 1,0 mol glucozơ tạo thành CO2 và H2O toả ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500 ml dung dịch glucozơ 5%. Năng lượng tối đa từ phản ứng oxi hoá hoàn toàn glucozơ mà bệnh nhân đó có thể nhận được là
Đốt cháy hoàn toàn 0,5 mol hỗn hợp X gồm ba este A, B, C (MA < MB < MC, số mol nB > nC) đều mạch hở với lượng oxi vừa đủ, thu được 2,2 mol CO2 và 1,7 mol H2O. Mặt khác, hidro hóa hoàn toàn 0,5 mol X cần dùng a mol H2 (xúc tác Ni, t°) thu được hỗn hợp Y gồm hai este. Đun nóng toàn bộ Y với 700 ml dung dịch NaOH 1M (vừa đủ), thu được một muối của axit hữu cơ có tráng bạc và hỗn hợp Z gồm hai ancol có cùng số nguyên tử cacbon. Giá trị a và phần trăm khối lượng chất B trong X lần lượt là
Khi đốt cháy hoàn toàn 8,64 gam hỗn hợp glucozơ và saccarozơ cần vừa đủ 0,3 mol O2, thu được CO2 và m gam H2O. Giá trị của m là