(2023) Đề thi thử Hóa học THPT Kim Sơn A, Ninh Bình (Lần 3) có đáp án
(2023) Đề thi thử Hóa học THPT Kim Sơn A, Ninh Bình (Lần 3) có đáp án
-
221 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Cho phản ứng hóa học: Zn + 2AgNO3 → Zn(NO3)2 + 2Ag. Trong phản ứng trên xảy ra
 Xem đáp án
Xem đáp án
Trong phản ứng trên xảy ra sự oxi hóa Zn (số oxi hóa tăng từ 0 lên +2) và sự khử Ag+ (số oxi hóa giảm từ +1 xuống 0)
Chọn C
Câu 2:
Hoà tan m gam Al bằng dung dịch HCl (dư), thu được 6,72 lít H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
2Al + 6HCl → 2AlCl3 + 3H2
nH2 = 0,3 → nAl = 0,2 → mAl = 5,4 gam
Chọn B
Câu 5:
Đốt cháy m gam hỗn hợp X gồm Zn, Al, Mg và Fe trong bình chứa 0,1 mol O2, thu được hỗn hợp Y. Hòa tan toàn bộ Y trong dung dịch HCl dư, thu được 0,15 mol H2 và dung dịch chứa 38,05 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Bảo toàn điện tích → nCl- (muối) = ne = 4nO2 + 2nH2 = 0,7
→ mX = m muối – mCl = 13,2 gam
Chọn C
Câu 7:
Hoà tan a gam FeSO4.7H2O trong nước thu được 300 ml dung dịch X. Thêm H2SO4 loãng dư vào 20 ml dung dịch X, dung dịch hỗn hợp này làm mất màu 30 ml dung dịch KMnO4 0,1M. Giá trị của a là
 Xem đáp án
Xem đáp án
Bảo toàn electron:
nFe2+ (trong 20ml X) = 5nKMnO4 = 0,015
→ nFe2+ trong 300 ml X = 0,225
→ mFeSO4.7H2O = 0,225.278 = 62,55 gam
Chọn B
Câu 8:
Khi đốt cháy hoàn toàn 8,64 gam hỗn hợp glucozơ và saccarozơ cần vừa đủ 0,3 mol O2, thu được CO2 và m gam H2O. Giá trị của m là
 Xem đáp án
Xem đáp án
Các chất glucozơ và saccarozơ có dạng Cn(H2O)m nên:
nC = nO2 = 0,3
→ mH2O = m hỗn hợp – mC = 5,04
Chọn A
Câu 9:
Đốt cháy kim loại X trong oxi, thu được oxit Y. Hòa tan Y trong dung dịch H2SO4 loãng dư, thu được dung dịch Z chứa hai muối. Kim loại X là
 Xem đáp án
Xem đáp án
Kim loại X là Fe:
Fe + O2 → Fe3O4
Fe3O4 + H2SO4 → FeSO4 + Fe2(SO4)3 + H2O
Chọn D
Câu 10:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, anilin là bazơ yếu, không làm đổi màu quỳ tím.
B. Sai, thành phần chính của bột ngọt là muối mononatri glutamat.
C. Sai, Lys có 2N (C6H14N2O2)
D. Đúng.
Chọn D
Câu 11:
Cho các phát biểu sau:
(a) Tơ nitron được điều chế bằng phản ứng trùng ngưng.
(b) Ở điều kiện thường, alanin là chất rắn.
(c) Ở điều kiện thích hợp, tripanmitin tham gia phản ứng cộng H2.
(d) Thủy phân saccarozơ trong môi trường kiềm thu được glucozơ và fructozơ.
(e) Thủy tinh hữu cơ khi vỡ tạo ra các hạt tròn không có cạnh sắc.
(g) Lưu hóa cao su buna bằng lưu huỳnh, thu được cao su buna-S.
Số phát biểu sai là:
 Xem đáp án
Xem đáp án
(a) Sai, tơ nitron điều chế bằng phản ứng trùng hợp CH2=CH-CN
(b) Đúng, alanin tồn tại ở dạng ion lưỡng cực nên có dạng tinh thể (thể rắn) điều kiện thường
(c) Sai, tripanmitin là chất béo no
(d) Sai, saccarozơ không bị thủy phân trong kiềm
(e) Đúng
(g) Sai, cao su buna-S điều chế từ đồng trùng hợp CH2=CH-CH=CH2 và C6H5-CH=CH2
Chọn D
Câu 12:
α-aminoaxit X chứa một nhóm -NH2. Cho 10,3 gam X tác dụng với axit HCl (dư), thu được 13,95 gam muối khan. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
nHCl = (m muối – mX)/36,5 = 0,1
→ MX = 103
X dạng NH2-R-COOH → R = 42: -C3H6-
→ X là CH3CH2CH(NH2)COOH
Chọn A
Câu 13:
Cho các phát biểu sau
(a) Điện phân dung dịch CaCl2, thu được Ca ở catot.
(b) Than hoạt tính được sử dụng nhiều trong mặt nạ phòng độc, khẩu trang y tế.
(c) Cho Ba(HCO3)2 vào dung dịch KHSO4 sinh ra kết tủa và khí.
(d) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 xảy ra ăn mòn điện hóa.
(e) Để phân biệt khí CO2 và SO2 có thể dùng dung dịch nước vôi trong.
(f) Có thể dùng dung dịch NaOH để làm mềm nước cứng tạm thời.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, thu được H2 ở catot:
CaCl2 + H2O → H2 + Cl2 + Ca(OH)2
(b) Đúng
(c) Đúng: KHSO4 + Ba(HCO3)2 → BaSO4 + K2SO4 + CO2 + H2O
(d) Đúng: Fe + CuSO4 → FeSO4 + Cu
Cu sinh ra bám vào lá Fe làm xuất hiện cặp điện cực Fe-Cu cùng tiếp xúc với dung dịch điện li nên có ăn mòn điện hóa.
(e) Sai, cả CO2 và SO2 đều tạo kết tủa trắng với Ca(OH)2 dư.
(f) Đúng: M(HCO3)2 + NaOH → MCO3 + Na2CO3 + H2O
Chọn A
Câu 14:
Các núi đá dọc bờ sông hay ở dưới biển thì có hiện tượng chân núi đá bị ăn mòn lõm vào tạo hốc sâu, hang động… Ngoài tác động mài mòn của nước thì có nguyên nhân chính là có phản ứng hóa học xảy ra trong thời gian dài. Phản ứng đó là
 Xem đáp án
Xem đáp án
Nguyên nhân chính của hiện tượng núi đá bị ăn mòn lõm vào tạo hốc sâu là sự xâm thực của H2O có hòa tan CO2:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Chọn B
Câu 16:
Cho vào ống nghiệm một vài tinh thể K2Cr2O7, sau đó thêm tiếp khoảng 1 ml nước và lắc đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch KOH vào dung dịch X, thu được dung dịch Y. Màu sắc của dung dịch X và Y lần lượt là
 Xem đáp án
Xem đáp án
Màu sắc của dung dịch X và Y lần lượt là màu da cam và màu vàng chanh:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
(da cam)……………(vàng)
Chọn B
Câu 17:
Cho các polime sau: polietilen, tơ lapsan, tơ visco, polistiren, polibutađien, tơ nilon-6,6, tơ olon. Số polime được điều chế bằng phản ứng trùng hợp là:
 Xem đáp án
Xem đáp án
Các polime được điều chế bằng phản ứng trùng hợp là: polietilen, polistiren, polibutađien, tơ olon.
Chọn B
Câu 19:
Vùng đồng bằng sông Cửu Long nước có nhiều phù sa. Để xử lí phù sa cho keo tụ lại thành khối lớn, dễ dàng tách ra khỏi nước (làm trong nước) làm nguồn nước sinh hoạt, người ta thêm vào nước một lượng chất
 Xem đáp án
Xem đáp án
Chọn A
Câu 20:
Cho một mẫu quặng photphorit X (chứa 88,35% khối lượng Ca3(PO4)2, còn lại là tạp chất trơ không chứa photpho) tác dụng với dung dịch H2SO4 đặc (vừa đủ). Sau phản ứng hoàn toàn, làm khô hỗn hợp, thu được supephotphat đơn Y. Độ dinh dưỡng của Y là
 Xem đáp án
Xem đáp án
Lấy 100 gam quặng → nCa3(PO4)2 = 100.88,35%/310 = 0,285
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
0,285…………….0,57
→ mY = m quặng + mH2SO4 = 155,86
Độ dinh dưỡng = %P2O5 = 0,285.142/155,86 = 25,97%
Chọn C
Câu 23:
Hỗn hợp E gồm hai axit oleic, axit panmitic và chất béo Y (có tỉ lệ mol nAxit : nY = 5 : 4). Cho E vào dung dịch NaOH dư (đun nóng), sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch Z. Cô cạn dung dịch Z thu được chất rắn T có khối lượng 53,06 gam chứa 3 chất rắn khan. Đốt cháy hoàn toàn T thu được Na2CO3; 2,795 mol CO2 và 2,775 mol H2O. Phần trăm khối lượng của Y trong E có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
T gồm C15H31COONa (a), C17H33COONa (b) và NaOH dư (c)
mT = 278a + 304b + 40c = 53,06
nNa2CO3 = 0,5(a + b + c)
→ nC = 16a + 18b = 0,5(a + b + c) + 2,795
nH = 31a + 33b + c = 2,775.2
→ a = 0,07; b = 0,1; c = 0,08
n muối = nAxit + 3nY = a + b = 0,17
nAxit : nY = 5 : 4 → nAxit = 0,05 và nY = 0,04
nNaOH ban đầu = a + b + c = 0,25; nC3H5(OH)3 = 0,04 và nH2O = 0,05
Bảo toàn khối lượng → mE = 47,64
Từ a, b và nY → Y là (C15H31COO)(C17H33COO)2C3H5 (0,04 mol)
→ %Y = 72,04%
Chọn B
Câu 25:
Butan là một trong hai thành phần chính của khí đốt hóa lỏng (Liquified Petroleum Gas-viết tắt là LPG). Khi đốt cháy 1 mol butan tỏa ra lượng nhiệt là 2497 kJ. Để thực hiện việc đun nóng 1 gam nước tăng thêm 1°C cần cung cấp nhiệt lượng là 4,18J. Khối lượng butan cần đốt để đưa 2 lít nước từ 25°C lên 100°C. Biết rằng khối lượng riêng của nước là 1 g/ml và hiệu suất nhiệt lượng tỏa ra khi đốt cháy butan dùng để nâng nhiệt độ của nước là 60%
 Xem đáp án
Xem đáp án
mH2O = 2000.1 = 2000 gam
Để làm sôi lượng H2O này cần nhiệt lượng = 2000.4,18.(100 – 25) = 627000J = 627 kJ
→ nC4H10 cần dùng = 627/(2497.60%) = 0,4185
→ mC4H10 = 24,273 gam
Chọn B
Câu 29:
Cho sơ đồ chuyển hóa:
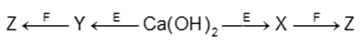
Biết: X, Y, Z, E, F là các hợp chất khác nhau; mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E, F thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Ca(OH)2 có 2 phản ứng khác nhau với cùng chất E → Loại A, B.
Loại D do CaCO3 không phản ứng với Na2SO4.
Chọn C: E, F là NaHCO3, HCl
X là CaCO3; Y là Na2CO3, Z là CO2
Chọn C
Câu 31:
Đốt cháy hoàn toàn 0,5 mol hỗn hợp X gồm ba este A, B, C (MA < MB < MC, số mol nB > nC) đều mạch hở với lượng oxi vừa đủ, thu được 2,2 mol CO2 và 1,7 mol H2O. Mặt khác, hidro hóa hoàn toàn 0,5 mol X cần dùng a mol H2 (xúc tác Ni, t°) thu được hỗn hợp Y gồm hai este. Đun nóng toàn bộ Y với 700 ml dung dịch NaOH 1M (vừa đủ), thu được một muối của axit hữu cơ có tráng bạc và hỗn hợp Z gồm hai ancol có cùng số nguyên tử cacbon. Giá trị a và phần trăm khối lượng chất B trong X lần lượt là
 Xem đáp án
Xem đáp án
nY = nX = 0,5; nNaOH = 0,7 → Trong Y chứa este đơn chức và đa chức.
X + H2 → Y chứa 2 este nên trong X có 2 chất có cùng số C và số O.
Muối có tráng bạc là HCOONa, ancol cùng C nên ít nhất 3C → Các chất trong X ít nhất 4C
nCO2 – nH2O = nX nên X có k trung bình = 2
Số C = nCO2/nX = 4,4
(Chú ý: Bấm hệ nX, nCO2, nH2O để tính số mol este dưới đây)
TH1:
A là HCOO-CH2-C≡CH (0,15 mol)
B là HCOO-CH2-CH2-CH3 (0,15 mol)
C là (HCOO)2C3H6 (0,2 mol)
Loại do không thỏa mãn nB > nC
TH2:
A là HCOO-CH2-CH=CH2 (0,3 mol)
B là HCOO-CH2-CH2-CH3 (0,1 mol)
C là (HCOO)3C3H5 (0,1 mol)
Loại do không thỏa mãn nB > nC
TH3:
A là HCOO-CH2-C≡CH (0,15 mol)
B là HCOO-CH2-CH2-CH3 (0,25 mol)
C là (HCOO)3C3H5 (0,1 mol)
Nghiệm thỏa mãn nB > nC
→ nH2 = 2nA = 0,3 và %B = 42,15%
Chọn A
Câu 32:
Tiến hành điện phân dung dịch X chứa m gam hỗn hợp gồm CuSO4 và NaCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A. Quá trình điện phân được ghi nhận như sau:
+ Sau thời gian t giây thu được dung dịch Y; đồng thời ở anot thoát ra V lít khí (đktc). Cho dung dịch H2S dư vào Y, thu được 9,6 gam kết tủa. Nếu nhúng thanh Fe vào Y, kết thúc phản ứng, thấy khối lượng Fe giảm 2,0 gam so với ban đầu.
+ Sau thời gian 2t giây, tổng thể tích khí thoát ra ở hai điện cực là 4,48 lít (đktc).
Các khí sinh ra không tan trong dung dịch và quá trình điện phân đạt hiệu suất 100%. Cho các nhận định sau:
(a) Giá trị của t là 5404.
(b) Nếu thời gian điện phân là 3088 giây thì nước bắt đầu điện phân ở anot.
(c) Giá trị của m là 46,16.
(d) Giá trị của V là 2,24.
Số nhận định đúng là:
 Xem đáp án
Xem đáp án
Y + Fe làm khối lượng thanh Fe giảm nên Y chứa H2SO4 và Cl- đã bị điện phân hết.
nCuSO4 dư = nCuS = 0,1; nH2SO4 = p
nFe phản ứng = p + 0,1
→ 0,1.64 – 56(p + 0,1) = -2 → p = 0,05
Anot: nCl2 = x; nO2 = nH+/4 = 0,025
Catot: nCu = x + 0,05
→ nCuSO4 ban đầu = x + 0,15
ne trong t giây = 2x + 0,1 → ne trong 2t giây = 4x + 0,2
Sau 2t giây:
Anot: nCl2 = x → nO2 = 0,5x + 0,05
Catot: nCu = x + 0,15 → nH2 = x – 0,05
n khí tổng = x + 0,5x + 0,05 + x – 0,05 = 0,2
→ x = 0,08
ne trong t giây = 2x + 0,1 = 0,26 = It/F → t = 5018 (a sai)
Khi hết Cl- thì ne = 2x = It/F → t = 3088 (b đúng)
nCuSO4 = x + 0,15 = 0,23 và nNaCl = 2x = 0,16
→ m = 46,16 (c đúng)
n khí sau t giây = x + 0,025 = 0,105 → V = 2,352 (d sai)
Chọn C
Câu 34:
Hòa tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là:
 Xem đáp án
Xem đáp án
X chứa Al2(SO4)3, FeSO4, H2SO4 dư
Y gồm Fe(OH)2, BaSO4
Z gồm Fe2O3, BaSO4.
Chọn C
Câu 35:
Dung dịch glucozơ (C6H12O6) 5%, có khối lượng riêng là 1,02 g/ml, phản ứng oxi hoá 1,0 mol glucozơ tạo thành CO2 và H2O toả ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500 ml dung dịch glucozơ 5%. Năng lượng tối đa từ phản ứng oxi hoá hoàn toàn glucozơ mà bệnh nhân đó có thể nhận được là
 Xem đáp án
Xem đáp án
nC6H12O6 = 500.1,02.5%/180 = 0,14167
Năng lượng tối đa = 0,14167.2803 = 397,1 kJ
Chọn B
Câu 37:
Cho ba hợp chất hữu cơ mạch hở E (C4H8O4), F (C4H6O4) và G (C5H8O5). Thực hiện sơ đồ chuyển hóa sau:
E + KOH → X + Y
F + KOH → X + Z + T
G + KOH → X + T
X + HCl → Q + KCl
Biết X, Y, Z, T là các hợp chất hữu cơ; Y và T chứa cùng một loại nhóm chức và hơn kém nhau một nguyên tử cacbon. Cho các nhận định sau:
(a) Chất G có hai công thức cấu tạo thỏa mãn.
(b) Phần trăm khối lượng oxi trong chất Q bằng 63,16%.
(c) Trong công nghiệp, chất Y được điều chế từ chất béo.
(d) Axit axetic được điều chế trực tiếp từ chất T.
(e) E, F và G đều tham gia phản ứng tráng bạc.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
F (C4H6O4) + KOH tạo 3 chất hữu cơ nên F là HCOO-CH2-COO-CH3
Y và T chứa cùng một loại nhóm chức và hơn kém nhau một nguyên tử cacbon nên E là HO-CH2-COO-CH2-CH2OH
X là HO-CH2-COOK; Y là C2H4(OH)2; Z là HCOOK; T là CH3OH
G là HO-CH2-COO-CH2-COO-CH3
Q là HO-CH2-COOH
(a) Sai, G có 1 cấu tạo duy nhất.
(b) Đúng, %O trong Q = 48/76 = 63,16%
(c) Sai, Y điều chế từ C2H4
(d) Đúng, CH3OH + CO → CH3COOH
(e) Sai, E và G không tráng bạc, F có tráng bạc.
Chọn B
Câu 39:
Hợp chất nào sau đây không thuộc loại đipeptit ?
 Xem đáp án
Xem đáp án
Hợp chất H2N—CH2—CH2—CONH—CH2—CH2—COOH không thuộc loại đipeptit vì mắt xích H2N—CH2—CH2—CO— không tạo bởi α-amino axit.
Chọn D
Câu 40:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Đúng, do không có 2 điện cực và không có môi trường điện li nên chỉ có quá trình ăn mòn hóa học.
B. Đúng, Hg là kim loại thể lỏng duy nhất ở điều kiện thường nên nhiệt độ nóng chảy của nó thấp nhất.
C. Sai, Be không phản ứng.
D. Đúng, vì chậu sẽ bị thủng do phản ứng:
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
Al + H2O + Ca(OH)2 → Ca(AlO2)2 + H2
Chọn C
