(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Bình Thuận có đáp án
(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Bình Thuận có đáp án
-
583 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Hợp chất X là chất rắn màu trắng, không tan trong nước và bền với nhiệt. Công thức hoá học của X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 2:
Kim loại M là kim loại cứng nhất, được sử dụng để mạ các dụng cụ kim loại, chế tạo các loại thép chống gỉ, không gỉ… Kim loại M là
 Xem đáp án
Xem đáp án
Chọn C
Câu 3:
Triglixerit X là trieste của glixerol với axit cacboxylic Y. Axit Y có thể là
 Xem đáp án
Xem đáp án
Chọn B
Câu 5:
Trong tự nhiên, khí X được tạo thành khi có sấm sét. Ở điều kiện thường, khí X phản ứng với oxi trong không khí, tạo thành khí có màu nâu đỏ. Khí X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 19:
Cho các phát biểu sau:
(a) Ở điều kiện thường, chất béo (C17H33COO)3C3H5 ở trạng thái lỏng.
(b) Fructozơ là monosaccarit duy nhất có trong mật ong.
(c) Thành phần dầu mỡ bôi trơn xe máy có thành phần chính là chất béo.
(d) Thành phần chính của giấy chính là xenlulozơ.
(e) Amilozơ và amilopectin đều cấu trúc mạch phân nhánh.
(f) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
(a) Đúng, (C17H33COO)3C3H5 là chất béo không no nên ở trạng thái lỏng.
(b) Sai, mật ong chứa nhiều fructozo và glucozo
(c) Sai, dầu mỡ bôi trơn có thành phần hidrocacbon
(d) Đúng
(e) Sai, amilozo không nhánh
(f) Đúng
Chọn C
Câu 20:
Chất nào không dùng làm chất khử khi điều chế kim loại bằng phương pháp nhiệt luyện?
 Xem đáp án
Xem đáp án
Không dùng S làm chất khử khi điều chế kim loại bằng phương pháp nhiệt luyện vì S không khử được ion kim loại.
Chọn B
Câu 21:
Trong phản ứng của kim loại Ca với H2O, với hệ số phương trình phản ứng là số nguyên tối giản thì hệ số của H2O là
 Xem đáp án
Xem đáp án
Ca + 2H2O —> Ca(OH)2 + H2
—> Hệ số của H2O là 2.
Chọn C
Câu 22:
Cho các phát biểu sau:
(a) Ở nhiệt độ cao, kim loại nhôm khử được Fe2O3.
(b) Điện phân nóng chảy Al2O3, thu được kim loại Al ở anot.
(c) Nhỏ dung dịch HCl vào CaCO3, thu được khí CO2.
(d) Sục khí CO2 vào dung dịch Ca(HCO3)2, thu được kết tủa.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng: Al + Fe2O3 —> Al2O3 + Fe
(b) Sai, thu được Al ở catot, O2 ở anot.
(c) Đúng: HCl + CaCO3 —> CaCl2 + CO2 + H2O
(d) Sai, CO2 không phản ứng với Ca(HCO3)2.
Chọn C
Câu 23:
Đun nóng este CH3COOC6H5 (phenyl axetat) với lượng dư dung dịch NaOH, thu được các sản phẩm hữu cơ là
 Xem đáp án
Xem đáp án
CH3COOC6H5 + 2NaOH —> CH3COONa + C6H5ONa + H2O
—> Các sản phẩm hữu cơ: CH3COONa và C6H5ONa.
Chọn A
Câu 24:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, trùng hợp buta-1,3-đien thu được cao su buna.
B. Đúng
C. Sai, policaproamit được điều chế bằng phản ứng trùng hợp caprolactam hoặc trùng ngưng axit ε-aminocaproic.
D. Sai, amilozơ có cấu trúc mạch polime không phân nhánh.
Chọn B
Câu 25:
Cho sơ đồ phản ứng sau:
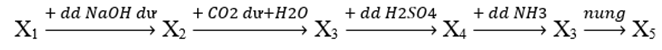
Biết X1, X2, X3, X4, X5 là các chất khác nhau của nguyên tố nhôm. Các chất X1 và X5 lần lượt là
 Xem đáp án
Xem đáp án
Theo sơ đồ thì X2 là NaAlO2; X3 là Al(OH)3
X4 là Al2(SO4)3; X5 là Al2O3
Từ X5 —> Loại A, C. Để các chất khác nhau thì chọn D.
Chọn D
Câu 26:
Cho các chất sau: Fe2O3, FeO, Fe3O4 và Fe. Số chất tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO là
 Xem đáp án
Xem đáp án
Có 3 chất trong đó Fe có số oxi hóa chưa tối đa nên khi tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO là FeO, Fe3O4 và Fe.
Chọn C
Câu 27:
Chất X là chất dinh dưỡng, được dùng làm thuốc tăng lực cho người già, trẻ nhỏ và người ốm. Trong công nghiệp, X được điều chế bằng cách thủy phân chất Y. Chất Y là nguyên liệu để làm bánh kẹo, nước giải khát. Tên gọi của X, Y lần lượt là
 Xem đáp án
Xem đáp án
Chất X là chất dinh dưỡng, được dùng làm thuốc tăng lực cho người già, trẻ nhỏ và người ốm —> X là glucozơ.
Chất Y là nguyên liệu để làm bánh kẹo, nước giải khát —> Y là saccarozơ.
Chọn D
Câu 28:
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch KHSO4.
(b) Cho K vào dung dịch CuSO4 dư.
(c) Cho dung dịch NH4NO3 vào dung dịch Ba(OH)2.
(d) Cho dung dịch HCl tới dư vào dung dich C6H5ONa.
(e) Cho dung dịch CO2 tới dư vào dung dịch gồm NaOH và Ca(OH)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả chất rắn và khí là
 Xem đáp án
Xem đáp án
(a) Ba(HCO3)2 + KHSO4 —> BaSO4 + K2SO4 + CO2 + H2O
(b) K + H2O —> KOH + H2
KOH + CuSO4 —> K2SO4 + Cu(OH)2
(c) NH4NO3 + Ba(OH)2 —> Ba(NO3)2 + NH3 + H2O
(d) HCl + C6H5ONa —> C6H5OH + NaCl
(e) CO2 dư + Ca(OH)2 —> Ca(HCO3)2
CO2 dư + NaOH —> NaHCO3
Chọn D
Câu 29:
Thuỷ phân hoàn toàn 10,56 gam este no, đơn chức, mạch hở X với 100,00 ml dung dịch NaOH 1,20M (vừa đủ) thu được 5,52 gam một ancol Y. Tên gọi của X là
 Xem đáp án
Xem đáp án
nX = nY = nNaOH = 0,12
MX = 10,56/0,12 = 88: X là C4H8O2
MY = 5,52/0,12 = 46: Y là C2H5OH
—> Cấu tạo của X: CH3COOC2H5 (etyl axetat).
Chọn B
Câu 30:
Hòa tan hết 2 gam hỗn hợp gồm MgO và Ca cần vừa đủ V ml dung dịch HCl 1M, chỉ thu được dung dịch chứa hai muối. Giá trị của V là
 Xem đáp án
Xem đáp án
MgO + 2HCl —> MgCl2 + H2O
Ca + 2HCl —> CaCl2 + H2
nHCl = 2(nMgO + nCa) = 2.2/40 = 0,1
—> VddHCl = 100 ml
Chọn A
Câu 31:
Một loại phân NPK có độ dinh dưỡng được ghi trên bao bì 19-12-6. Để cung cấp 22,69 kg nitơ, 3,72 kg photpho và 6,07 kg kali cho một thửa ruộng, người ta sử dụng đồng thời phân NPK (ở trên), đạm urê (độ dinh dưỡng là 46%) và phân kali (độ dinh dưỡng là 61%). Tổng khối lượng phân bón đã sử dụng là
 Xem đáp án
Xem đáp án
Lượng phân đã dùng gồm NPK (x kg), đạm urê (y kg) và phân kali (z kg)
mN = 22,69 = 19%x + 46%y
mP = 3,72 = 31.2.12%x/142
mK = 6,07 = 39.2.6%x/94 + 39.2.61%z/94
—> x = 71; y = 20; z = 5
—> x + y + z = 96
Chọn D
Câu 32:
Cho 2,110 gam hỗn hợp X gồm metylamin, đimetylamin phản ứng vừa đủ với 0,050 mol HCl, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng:
m muối = 2,11 + 0,05.36,5 = 3,935 gam
Chọn C
Câu 33:
Thủy phân 1,71 gam saccarozơ với hiệu suất 75%, thu được hỗn hợp X. Cho toàn bộ X vào lượng dư dung dịch AgNO3 trong NH3, đun nóng, sau khi các phản ứng xảy ra hoàn toàn, thu được m gam Ag. Giá trị của m là ?
 Xem đáp án
Xem đáp án
nC12H22O11 = 1,71.75%/342 = 3/800
C12H22O11 —> (Glucozơ + Fructozơ) —> 4Ag
—> nAg = 4nC12H22O11 = 0,015
—> mAg = 1,62
Chọn C
Câu 34:
Đốt cháy kim loại M (có hoá trị không đổi) trong 0,168 lít khí O2 đến phản ứng hoàn toàn được chất rắn X. Hòa tan hết X trong dung dịch HCl dư thu được 0,336 lít khí H2 và dung dịch Y có chứa 2,67 gam muối. Muối trong Y là :
 Xem đáp án
Xem đáp án
nO2 = 0,0075; nH2 = 0,015
—> nCl- (muối) = ne = 4nO2 + 2nH2 = 0,06
Kim loại M hóa trị x —> (2,67 – 0,06.35,5)x/M = 0,06
—> M = 9x —> x = 3, M = 27: M là Al, muối là AlCl3Câu 35:
Thuỷ phân hoàn toàn chất hữu cơ E (C9H14O4, mạch hở, chứa hai chức este) bằng dung dịch NaOH, thu được sản phẩm gồm ancol X và hai chất hữu cơ Y, Z (MX < MY = MZ). Biết Z có thể tác dụng với dung dịch AgNO3 trong NH3, đun nóng, thu được kết tủa. Cho các phát biểu sau:
(a) Nhiệt độ sôi của chất X nhỏ hơn nhiệt độ sôi của ancol metylic.
(b) Khi cho a mol Z tác dụng với Na dư, thu được a mol H2.
(c) Có 2 công thức cấu tạo thỏa mãn tính chất của E.
(d) Y và Z có cùng công thức đơn giản nhất.
(e) Hợp chất hữu cơ E có đồng phân hình học.
Số phát biểu đúng là :
 Xem đáp án
Xem đáp án
E có k = 3, gồm 2COO và 1C=C
Nếu X là ancol 2 chức no, lúc đó Y, Z là các muối đơn và C=C nằm ở 1 trong 2 muối này nên không thể có MY = MZ
Nếu X là ancol 2 chức chứa C=C (ít nhất 4C), Y và Z là các muối đơn chia nhau 5C còn lại cũng không thể có MY = MZ
Vậy X là ancol đơn. Z tráng gương nên Z chứa CHO.
E là C3H7COO-CH=CH-COO-C2H5
X là C2H5OH
Y là C3H7COONa
Z là OHC-CH2-COONa
(a) Sai, C2H5OH có phân tử khối lớn hơn CH3OH nên nhiệt độ sôi cao hơn.
(b) Sai, Z không tác dụng với Na
(c) Đúng, E có 2 cấu tạo (đồng phân mạch C của C3H7-)
(d) Sai
(e) Đúng
Chọn B
Câu 36:
Bình “ga” loại 12 cân sử dụng trong hộ gia đình X có chứa 12 kg khí hoá lỏng (LPG) gồm propan và butan với tỉ lệ mol tương ứng là 3 : 7. Khi được đốt cháy hoàn toàn, 1 mol propan tỏa ra lượng nhiệt là 2220 kJ và 1 mol butan tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình X là 13000 kJ/ngày và hiệu suất sử dụng nhiệt là 75%. Sau khoảng bao nhiêu ngày hộ gia đình X sử dụng hết bình ga trên?
 Xem đáp án
Xem đáp án
Mỗi bình gas chứa C3H8 (3x) và C4H10 (7x)
—> 44.3x + 58.7x = 12000 —> x = 22,305
Số ngày sử dụng = 70%(2220.3x + 2850.7x)/13000 = 34 ngày
Chọn A
Câu 37:
Xà phòng hoá hoàn toàn 131,70 gam hỗn hợp X gồm các triglixerit bằng dung dịch KOH vừa đủ, đun nóng, sau phản ứng thu được 143,10 gam hỗn hợp muối Y. Hiđro hoá hoàn toàn Y chỉ thu được muối kali stearat. Mặt khác, cứ 26,34 gam X phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là ?
 Xem đáp án
Xem đáp án
nC3H5(OH)3 = x; nKOH = 3x, bảo toàn khối lượng:
131,70 + 56.3x = 143,1 + 92x —> x = 0,15
Quy đổi Y thành C17H35COOK (3x) và H2
mY = 143,1 —> nH2 = -0,9
Tỉ lệ: 131,7 gam X phản ứng tối đa 0,9 mol Br2
—> 26,34 gam X phản ứng tối đa 0,18 mol Br2
Chọn D
Câu 38:
Điện phân dung dịch X chứa CuSO4 và NaCl với điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Toàn bộ khí sinh ra trong quá trình điện phân theo thời gian được biểu diễn theo đồ thị bên.
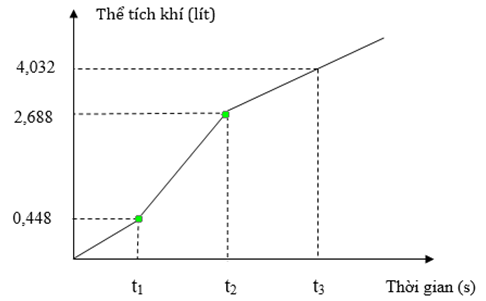
Giả sử hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước, bỏ qua sự bay hơi của nước. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đoạn 1: CuSO4 + NaCl —> Cu + Cl2 + Na2SO4
nCu = nCl2 = 0,02
Đoạn 2 có độ dốc lớn hơn nên khí thoát ra nhanh hơn —> Khí gồm H2 và Cl2:
2NaCl + 2H2O —> H2 + Cl2 + 2NaOH
n khí đoạn 2 = 0,12 – 0,02 = 0,1
—> nH2 = nCl2 = 0,05
Đoạn 3: 2H2O —> 2H2 + O2
n khí đoạn 3 = 0,06 —> nH2 = 0,04 và nO2 = 0,02
nCuSO4 = nCu = 0,02 và nNaCl = 2nCl2 tổng = 0,14
—> nCuSO4 : nNaCl = 1 : 7 (B sai)
Lúc t1 có ne = 0,04 —> Lúc 2t1 có ne = 0,08
nCu = 0,02; nH2 = 0,02; nCl2 = 0,04 —> V khí = 1,344 lít (A sai)
Thời điểm t3: nCu = 0,02; nH2 tổng = 0,09; nCl2 = 0,07, nO2 = 0,02 —> m giảm = 7,07 gam (C đúng)
D sai, dung dịch sau điện phân chứa NaOH nên pH > 7
Chọn C
Câu 39:
Cho 12,48 gam hỗn hợp X gồm Cu và Fe tác dụng hết với 3,36 lít hỗn hợp khí gồm Cl2 và O2, thu được chất rắn Y gồm các muối và oxit. Hòa tan vừa hết Y cần dùng 360,00 ml dung dịch HCl 1,00M, thu được dung dịch Z. Cho dung dịch AgNO3 dư vào Z, thu được 75,36 gam chất rắn. Mặt khác, hòa tan hết 12,48 gam X trong dung dịch HNO3 nồng độ 31,50%, thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất). Nồng độ phần trăm của Fe(NO3)3 trong T gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nHCl = 0,36 —> nH2O = 0,18 —> nO2 = 0,09 —> nCl2 = 0,06
Bảo toàn Cl —> nAgCl = 0,48
m↓ = mAgCl + mAg —> nAg = 0,06
Ban đầu nFe = a và nCu = b
—> mX = 56a + 64b = 12,48
Bảo toàn electron: 3a + 2b = 2nCl2 + 4nO2 + nAg
—> a = 0,12; b = 0,09
Dung dịch T chứa Fe(NO3)3 (x), Fe(NO3)2 (y) và Cu(NO3)2 (0,09)
Bảo toàn Fe —> x + y = 0,12
Bảo toàn electron: 3x + 2y + 0,09.2 = 0,15.3
—> x = 0,03; y = 0,09
nHNO3 = 4nNO = 0,6 —> mddHNO3 = 0,6.63/31,5% = 120
mddT = mX + mddHNO3 – mNO = 127,98
—> C%Fe(NO3)3 = 5,67%
Chọn B
Câu 40:
Hỗn hợp M gồm hai este X, Y mạch hở, hơn kém nhau một nguyên tử cacbon (đều tạo bởi axit cacboxylic và ancol). Đun 19,6 gam M với dung dịch KOH vừa đủ, thu được một ancol Z (MZ < 120) và hỗn hợp muối T. Đốt cháy toàn bộ T cần dùng 0,33 mol O2, thu được K2CO3; 17,06 gam hỗn hợp CO2 và H2O. Cho toàn bộ ancol Z vào bình đựng Na dư thấy bình tăng 8,9 gam. Phần trăm khối lượng của muối có khối lượng phân tử lớn nhất trong T là :
 Xem đáp án
Xem đáp án
nKOH = e —> mZ = e + 8,9
nK2CO3 = 0,5e, bảo toàn khối lượng:
19,6 + 56e = (17,06 + 138.0,5e – 0,33.32) + (e + 8,9)
—> e = 0,3
Z dạng R(OH)r (0,3/r mol)
mZ = (R + 17r).0,3/r = 0,3 + 8,9
—> R = 41r/3 —> r = 3, R = 41, Z là C3H5(OH)3 (0,1)
Đốt muối tạo nCO2 = u và nH2O = v
—> 44u + 18v = 17,06
Bảo toàn O —> 2u + v + 3.0,5e = 0,33.2 + 2e
—> u = 0,31; v = 0,19
nM = nZ = 0,1 và nC(M) = nC(Z) + nC(T) = 0,76
—> Số C = nC/nM = 7,6
—> (HCOO)2(CH3COO)C3H5 (0,04) và C8HyO6 (0,06)
Bảo toàn H:
0,04.10 + 0,06y + e = 2v + 8nZ
—> y = 8: (CH≡C-COO)(HCOO)2C3H5
T chứa:
CH≡C-COOK: 0,06 mol
HCOOK: 0,2 mol
CH3COOK: 0,04 mol
—> %CH≡C-COOK = 23,82%
Chọn A
