(2023) Đề thi thử Hóa THPT theo đề minh họa của Bộ Giáo dục có đáp án (Đề 34)
(2023) Đề thi thử Hóa THPT theo đề minh họa của Bộ Giáo dục có đáp án (Đề 34)
-
1030 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 13:
Khí nào sau đây là một trong các khí gây hiện tượng mưa axit phá hủy công trình xây dựng và phá hủy mùa màng?
 Xem đáp án
Xem đáp án
Chọn A
Câu 21:
Cho 4,8 gam Mg tác dụng với dung dịch H2SO4 loãng dư, thu được V lít khí hiđro. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn B
® VH2 = 0,2 . 22,4 = 4,48 lit
Câu 22:
Vật liệu polime tổng hợp E có hình sợi dài, mảnh và giữ nhiệt tốt nên thường được dùng để dệt vải may quần áo ấm hoặc bện thành sợi “len” đan áo rét.

Biết E bền với nhiệt và bền trong môi trường axit và bazơ. Vật liệu E là
 Xem đáp án
Xem đáp án
Chọn A
Câu 23:
Cho các thí nghiệm sau, thí nghiệm nào sau phản ứng có giải phóng ra chất khí?
 Xem đáp án
Xem đáp án
Chọn B
Câu 24:
Cho 3,6 gam glucozơ tác dụng với dung dịch AgNO3 dư, trong NH3, đun nóng, hiệu suất phản ứng tráng gương 80%, thu được m gạm Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A
Câu 25:
Cho 14,6 gam peptit Gly – Ala tác dụng vừa đủ với dung dịch HCl, thu được dung dịch X chứa m gam muối. Giá trị m là
 Xem đáp án
Xem đáp án
Chon B
mmuối = 14,6 + 0,2 x 36,5 + 0,1 x 18 = 23,7 gam.
Câu 26:
Tiến hành lên men dung dịch chứa m gam glucozơ đựng trong một bình thủy tinh để tạo thành ancol etylic và khí cacbonic theo sơ đồ hình vẽ bên. Toàn bộ lượng khí cacbonic sinh ra được hấp thụ hết vào dung dịch Ca(OH)2 dư, thu được 6 gam kết tủa. Biết hiệu suất phản ứng lên men bằng 90%. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn D
Khối lượng glucozo thực tế:
Câu 27:
Đốt cháy 5,4 gam kim loại M (có hóa trị không đổi) trong V lít khí O2 đến phản ứng hoàn toàn được 8,6 gam chất rắn X. Hòa tan hết X trong dung dịch HCl dư thu được 2,24 lít khí H2. Kim loại M là
 Xem đáp án
Xem đáp án
Chọn A
® BTE: ® M = 9 n , với n = 3 thì m = 27 (Al)
Câu 28:
Xà phòng hóa hoàn toàn este X thu được ancol etylic và muối natri propionat. Công thức của X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 29:
Cho các thí nghiệm sau:
(a) Cho Fe vào dung dịch HCl dư.
(b) Cho Fe vào dung dịch AgNO3dư.
(c) Cho Fe dư vào dung dịch HNO3 loãng.
(d) Cho Fe vào dung dịch FeCl3 dư.
Số thí nghiệm sau khi kết thúc phản ứng có thu được muối sắt (II)?
 Xem đáp án
Xem đáp án
Chọn A
Câu 30:
Xà phòng hóa hoàn toàn 1,85 gam metyl axetat bằng dung dịch NaOH dư, thu được m gam muối. Giá trị m là
 Xem đáp án
Xem đáp án
Chọn D
CH3COOCH3 + NaOH → CH3COONa + CH3OH
0.025 mol → 0,025 mol
MCH3COONa = 0,025 x 82 = 2,05 gam.
Câu 31:
Cho các phát biểu sau:
(a) Cho dung dịch brom vào anlin thu được chất kết tủa màu trắng.
(b) Cao su thiên nhiên có cấu tạo là trùng hợp của butadien.
(c) Xenlulozơ có cấu trúc là polime không phân nhánh .
(d) Nhỏ vài giọt dung dịch I2 vào lát cắt của củ khoai lang xuất hiện màu xanh tím.
(đ) Nhỏ dung dịch Gly-Val – Ala vào ống nghiệm chứa Cu(OH)2 xuất hiện hợp chất màu tím.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn B
(b) Sai vì cao su thiên nhiên có cấu tạo là trùng hợp của íopren.
Câu 32:
Thực hiện các thí nghiệm sau:
(a) Cho kim loại Mg vào dung dịch CuSO4.
(b) Cho kim loại Ba vào dung dịch KHSO4 dư.
(c) Cho dung dịch NaHCO3 vào dung dịch H2SO4.
(d) Cho (NH4)2SO4 vào dung dịch Ba(OH)2 đun nóng.
(đ) Cho dung dịch Na2SO4 vào dung dịch Ba(HCO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm vừa thu được kết tủa vừa thu được chất khí là
 Xem đáp án
Xem đáp án
Chọn C
(a) Mg + + CuSO4 → MgSO4 + Cu
(b) Ba + 2H2O → Ba(OH)2 + H2↑ ; Ba(OH)2 + 2KHSO4 → + K2SO4 +2 H2O
(c) 2NaHCO3 + H2SO4 → Na2SO4 +2 CO2 + 2H2O
(d) (NH4)2 SO4+ Ba(OH)2 BaSO4 ↓ + 2NH3↑ + 2H2O
(đ) Na2SO4 + Ba(HCO3)2 → BaSO4↓ + 2NaHCO3
Câu 33:
HCl là một chất được phát hiện trong dịch vị dạ dạy có nồng độ 0,0001 – 0,001 mol/l và độ pH duy trì ở mức 3 – 4 đối với người bình thường. Nếu thiếu HCl trong dạ dày thì thức ăn không chuyển hóa được lâu dần gây suy nhược cơ thể nếu dư sẽ phá hủy đường ruột gây viêm loét dạ dày. Khi cơ thể dư HCl, người ta cần uống thuốc đau dạ dày (có tên gọi là thuốc muối – baking soda). Giả sử dịch vị dạ dày người bệnh chứa 1,5 lít dung dịch hỗn hợp thức ăn lỏng, trong đó chứa 1,5 lít dung dịch hỗn hợp thức ăn lỏng, trong đó chứa 0,09125 gam HCl. Nếu khả năng tiêu thụ baking soda của cơ thể người là 65% thì khối lượng baking soda của cơ thể người đó cần đưa vào cơ thể để duy trì pH trong mức 3 là bao nhiêu:
 Xem đáp án
Xem đáp án
Chọn A
nHCl trong dạ dày khi chưa uống baking soda =
pH = 3
Câu 34:
Hỗn hợp E gồm amin X (bậc III, no, đơn chức, mạch hở), anken Y và một ankin Z (số nguyên tử cacbon trong Z lớn hơn số nguyên tử cacbon trong Y, tỉ lệ mol giữa Y và Z tương ứng là 3 : 2). Đốt cháy hoàn toàn 11,15 gam hỗn hợp E cần dùng 35,6 gam O2, thu được hỗn hợp F gồm CO2, H2O và N2. Dẫn toàn bộ F qua bình đựng dung dịch NaOH đặc dư đến phản ứng hoàn toàn thấy khối lượng bình tăng thêm 46,05 gam. Phần trăm số mol của anken Y trong E là
 Xem đáp án
Xem đáp án
Chọn A
Câu 35:
Theo quy ước, một đơn vị độ cứng ứng với 0,5 milimol Ca2+ hoặc Mg2+ trong 1,0 lít nước. Một loại nước cứng chứa đồng thời các ion Ca2+, HCO3- và Cl-. Để làm mềm 10 lít nước cứng đó cần dùng vừa đủ 100 ml dung dịch chứa NaOH aM và Na3PO4 0,2M, thu được nước mềm (không chứa Ca2+) và 6,1 gam kết tủa. Số đơn vị độ cứng có trong nước cứng đó là:
 Xem đáp án
Xem đáp án
Chọn A
nNa3PO4 = 0,02 ® nCa3(PO4)2 = 0,01 ® nCaCO3 = (6,1 – mCa3(PO4)2)/100 = 0,03
Bảo toàn Ca ® nCa2+ = 0,06 ® 1 lít nước chứa 0,06/10 = 0,006 mol = 6 mmol
Số đơn vị độ cứng = 6/0,5 = 12
Câu 36:
Cho m gam hỗn hợp X gồm Fe(OH)2, CuO, Fe2O3 và FeS2 (trong đó oxi chiếm 20,645% về khối lượng) vào bình kín (thể tích không đổi) chứa 1,875 mol khí O2 (dư). Nung nóng bình đến khi các phản ứng xảy ra hoàn toàn rồi đưa về nhiệt độ ban đầu. Sau khi ngưng tụ toàn bộ hơi nước, áp suất trong binh bằng 90% so với áp suất ban đầu (coi thể tích chất rắn thay đổi không đáng kể). Mặt khác, hòa tan hoàn toàn m gam X bằng lượng dư dung dịch H2SO4 đặc, đun nóng thì thu được 1,575 mol SO2 (sản phẩm khử duy nhất) và dung dịch Y chứa 2 gam muối. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn D
Trong X, nFeS2 = a và nFe(OH)2 = b
Bảo toàn electron ® nO2 phản ứng = (11a + b)/4
nSO2 = 2a ® 1,875 – (11a + b)/4 + 2a = 1,875 – 1,875.10% (1)
X với H2SO4, bảo toàn electron: 15a + b = 1,575.2 (2)
(1)(2) ® a = 0,2 và b = 0,15
nH2SO4 phản ứng = x ® nH2O = x + 0,15
Bảo toàn khối lượng: m + 98x = 332m/155 + 1,575.64 + 18(x + 0,15) (3)
Bảo toàn S ® 2a + x = nSO42- (muối) + nSO2 ® nSO42- (muối) = x – 1,175
Bảo toàn O: 20,645%m/16 + 4x = 4(x – 1,175) + 1,575.2 + (x + 0,15) (4)
(3)(4) ® m = 77,5 và x = 2,4
Câu 37:
Thủy phân hoàn toàn m gam hỗn hợp hai este đơn chức, mạch hở E, F (ME < MF) trong 700 ml dung dịch KOH 1M thu được dung dịch X và hỗn hợp Y gồm 2 ancol CH3OH và C2H5OH. Thực hiện tách nước Y trong H2SO4 đặc ở 140°C thu được hỗn hợp Z. Trong Z tổng khối lượng của các ete là 8,04 gam (hiệu suất ete hóa của các ancol đều là 60%). Cô cạn dung dịch X được 53,0 gam chất rắn. Nung chất rắn này với CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được 6,72 lít hỗn hợp khí T (đktc). Tổng số nguyên tử có trong phân tử của F là ?
 Xem đáp án
Xem đáp án
Chọn D
Ta có :
Cắt ghép muối :
Chất F là C2H3COOCH3 không có khả năng tráng bạc.
Câu 38:
Điện phân dung dịch E chứa NaCl và CuSO4 bằng dòng điện một chiều có cường độ không đổi 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị sau
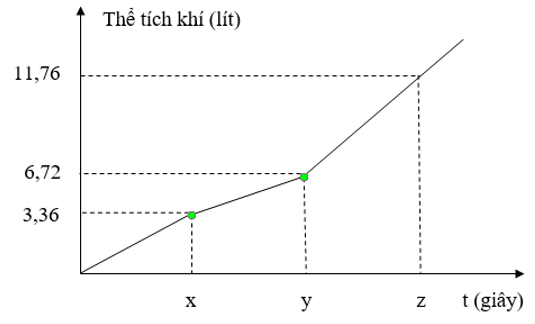
Cho các phát biểu sau:
(a) Tỉ lệ mol CuSO4 : NaCl trong E là 3 : 2.
(b) Tại thời điểm 3,5x giây, tổng thể tích khí thoát ra ở hai điện cực là 9,24 lít (đktc).
(c) Giá trị của y là 18335 giây.
(d) Tại thời điểm z giây, khối lượng dung dịch giảm 46,95 gam.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn A
Đoạn 1 thoát khí Cl2 ® nCl2 = 0,15
Đoạn 2 có độ dốc giảm nên tốc độ thoát khí giảm ® Đoạn 2 thoát O2 ® nO2 = 0,15 ® (a) Đúng
nNaCl = 2nCl2 = 0,3
Bảo toàn electron: 2nCu = 2nCl2 + 4nO2 ® nCuSO4 = nCu = 0,45 ® nCuSO4 : nNaCl = 3 : 2 ® (b) Đúng
ne trong x giây = 2nCl2 = 0,3 ® ne trong 3,5x giây = 0,3.3,5 = 1,05
|
Catot: nCu = 0,45 ® nH2 = 0,075 |
Anot: nCl2 = 0,15 ® nO2 = 0,1875 |
® n khí tổng = 0,4125 ® V = 9,24 ® (c) Sai
ne lúc y giây = 2nCu = It/F ® t = 17370s ® (d) Đúng
|
Catot: nCu = 0,45, nH2 = a |
Anot: nCl2 = 0,15, nO2 = b |
Bảo toàn electron: 2a + 0,45.2 = 2.0,15 + 4b
n khí tổng = a + b + 0,15 = 0,525 ® a = 0,15; b = 0,225 ® m giảm = 46,95 gam
Câu 39:
Cho sơ đồ các phản ứng sau:
(1) X1 + H2O X2 + X3 + H2
(2) X2 + X4 BaCO3 + Na2CO3 + H2O
(3) X2 + X3 X1 + X5 + H2O.
(4) X4 + X6 BaSO4 + Na2SO4 + CO2 + H2O.
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Chọn D
(1) 2NaCl + 2H2O 2NaOH + Cl2↑ + H2↑
(X1) (X2) (X3)
(2) 2NaOH + Ba(HCO3)2 → BaCO3↓ + Na2CO3 + 2H2O
(X4)
(3) 2NaOH + Cl2 → NaCl + NaClO + H2O
(X5)
(4) Ba(HCO3)2 + 2NaHSO4 → BaSO4↓ + Na2SO4 + 2CO2↑ + 2H2O
(X6)
Câu 40:
Cho E, Z, G, T đều là các hợp chất hữu cơ no, mạch hở và thỏa mãn sơ đồ các phản ứng:
Biết: E chỉ chứa nhóm chức este và trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi, ME < 168; MZ < MG < MT.
Cho các phát biểu sau:
(a) Đốt cháy a mol E cần 3a mol O2 (hiệu suất phản ứng 100%).
(b) Trong phân tử Z và T đều không có liên kết pi (π).
(c) Chất G được dùng để điều chế khí CO trong phòng thí nghiệm.
(d) 1 mol chất T phản ứng với kim loại Na dư, thu được tối đa 1 mol H2.
(e) Nhiệt độ sôi của G cao hơn nhiệt độ sôi của Z.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn A
