(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (17)
-
91 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
Vị chua của giấm ăn là do axit axetic gây nên. Công thức của axit axetic là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 5:
NaHCO3 được dùng làm bột nở, thuốc giảm đau dạ dày do thừa axit. Tên của NaHCO3 là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 6:
Mặt trái của "hiệu ứng nhà kính" là gây ra sự khác thường về khí hậu, gây hạn hán, lũ lụt, ảnh hưởng đến môi trường sinh thái và cuộc sống con người. Khí chủ yếu gây ra hiện tượng này là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 7:
Đốt cháy hoàn toàn bột sắt trong khí clo dư, thu được hợp chất trong đó sắt có số oxi hóa là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 8:
Ở điều kiện thường, kim loại nào sau đây tồn tại ở trạng thái lỏng?
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 10:
Trong cùng điều kiện, ion kim loại nào sau đây có tính oxi hóa mạnh nhất?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 14:
Trong công nghiệp, kim loại Fe được điều chế trực tiếp từ Fe2O3 bằng phương pháp
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 15:
Thạch cao nung được dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương. Công thức của thạch cao nung là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 17:
Thủy phân hoàn toàn tripanmitin trong dung dịch KOH thu được muối X và glixerol. Công thức của X là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 19:
Nhỏ dung dịch NH3 đến dư vào dung dịch chất nào sau đây thu được kết tủa keo, màu trắng?
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 21:
Cho Fe vào dung dịch H2SO4 (đặc nóng, dư) thu được dung dịch X. Thêm tiếp NaOH dư vào X, thu được kết tủa Y. Công thức của Y là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 22:
Cho 1,5 gam glyxin tác dụng hết với dung dịch KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 24:
Cho các polime sau: polibutađien, poli(metyl metacrylat), poliacrilonitrin, nilon–6,6. Số polime được điều chế bằng phản ứng trùng ngưng là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 25:
Thủy phân hoàn toàn este X (đơn chức, mạch hở) trong dung dịch NaOH, thu được muối có khối lượng lớn hơn khối lượng X. Công thức của X thỏa mãn là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 26:
Nhiệt phân hoàn toàn 12,2 gam hỗn hợp CaCO3 và MgCO3, thu được m gam chất rắn và 2,8 lít khí CO2. Giá trị m là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 27:
Từ m kg mùn cưa chứa 50% xenlulozơ (còn lại là tạp chất trơ) sản xuất được 80 kg glucozơ với hiệu suất toàn bộ quá trình là 80%. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 28:
Cần bao nhiêu tấn chất béo chứa 85% tristearin để sản xuất được 1,5 tấn xà phòng chứa 85% natri stearat (về khối lượng). Biết hiệu suất của phản ứng thuỷ phân là 85%.
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 30:
Oxi hóa hoàn toàn 11,5 gam hỗn hợp X gồm Mg, Al, Cu bằng O2, thu được 17,1 gam hỗn hợp Y gồm các oxit. Để hòa tan hết Y cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 31:
Cho các phát biểu sau:
(a) Thực hiện phản ứng trùng ngưng các amino axit đều thu được peptit.
(b) Fructozơ là hợp chất hữu cơ tạp chức.
(c) Axit 6–aminohexanoic là nguyên liệu để sản xuất tơ nilon–6.
(d) Bơ thực vật được chế biến từ dầu thực vật qua quá trình hiđro hóa.
(e) Thành phần của bột ngọt (mì chính) chỉ chứa các nguyên tố C, H, Na và O.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, sửa thành a- amino axit.
(b) Đúng.
(c) Đúng.
(d) Đúng.
(e) Sai, thiếu nguyên tố N.
Câu 32:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào ống nghiệm khô một ít etanol khan.
Bước 2: Đốt nóng sợi dây đồng kim loại đã cuộn thành lò xo trên ngọn lửa đèn cồn đến khi ngọn lửa không còn màu xanh (hình 1).
Bước 3: Nhúng nhanh sợi dây đồng trên vào ống nghiệm chứa etanol (hình 2).
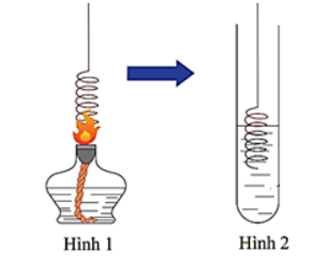
Cho các phát biểu sau:
(a) Trong bước 3, màu đen của dây đồng từ từ chuyển sang màu đỏ do CuO đã khử etanol thành anđehit axetic.
(b) Trong bước 2, dây đồng kim loại chuyển từ màu đỏ sang màu đen.
(c) Sản phẩm hữu cơ thu được ở bước 3 có tham gia phản ứng tráng bạc.
(d) Nếu thay etanol bằng propan-2-ol thì sản phẩm hữu cơ thu được ở bước 3 là anđehit.
(e) Có thể dùng thí nghiệm trên để phân biệt ancol bậc I với ancol bậc III.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
2Cu + O2 2CuO (đen)
CuO + C2H5OH CH3CHO + Cu (đỏ) + H2O
(a) Sai, CuO oxi hóa etanol.
(b) Đúng.
(c) Đúng, anđehit có phản ứng tráng bạc.
(d) Sai, propan-2-ol là ancol bậc II khi bị oxi hóa bởi CuO tạo sản phẩm là xeton
CH3CH(OH)CH3 + CuO CH3COCH3 + Cu + H2O
(e) Đúng vì ancol bậc III không có phản ứng oxi hóa trong điều kiện này.
Câu 33:
Hòa tan 6,82 gam đơn chất X trong dung dịch HNO3 dư, thu được 24,64 lít khí NO2 (sản phẩm khử duy nhất, đktc) và dung dịch Y. Cho Y tác dụng với V ml dung dịch chứa NaOH 1,2M và KOH 0,8M, thu được dung dịch chỉ chứa 47,616 gam muối trung hòa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
 Xem đáp án
Xem đáp án
X có thể C (nhường 4e), S (nhường 6e), P (nhường 5e)
BT e: nX.số e nhường = Þ .số e nhường = 1,1 Þ MX = 31 (photpho)
Dung dịch Y chứa H3PO4 và HNO3 còn dư
Khi cho Y tác dụng với NaOH (1,2V mol), KOH (0,8V mol) thu được muối trung hòa
® Na+ (1,2V mol), K+ (0,8V mol), NO3- (a mol), PO43- (0,22 mol, tính từ bảo toàn nguyên tố P)
BTĐT: 1,2V + 0,8V = a + 0,22.3 và 23.1,2V + 39.0,8V + 62a + 95.0,22 = 47,616
Þ V = 0,37 lít = 370 ml
Câu 34:
Hỗn hợp X gồm glyxin, alanin, lysin và axit glutamic; trong đó tỉ lệ khối lượng của nitơ và oxi là 7 : 20. Cho m gam X tác dụng với dung dịch NaOH (vừa đủ), thu được dung dịch Y chứa (m + 27,5) gam muối. Cho dung dịch HCl dư vào Y, cô cạn dung dịch sau phản ứng thu được 214,925 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Theo đề ta có: \[\frac{{{m_N}}}{{{m_O}}} = \frac{7}{{20}} \Rightarrow \frac{{{n_N}}}{{{n_O}}} = \frac{2}{5}\]
Cho X tác dụng với NaOH có: nNaOH = \[{n_{{H_2}O}}\] = a mol
Bảo toàn khối lượng: m + 40a = m + 27,5 + 18a ® a = 1,25 = nCOOH
Þ nO = 2a = 2,5 mol và nN = \[\frac{2}{5}\]nO = 1 mol
Gộp quá trình phản ứng (X và NaOH) phản ứng với HCl
® nHCl = nN + nNaOH = 2,25 mol và \[{n_{{H_2}O}}\] = nNaOH = 1,25 mol
Bảo toàn khối lượng: m + 40.1,25 + 2,25.36,5 = 214,925 + 1,25.18 Þ m = 105,3 gam
Câu 35:
Sơ đồ sản xuất etanol từ ngô của một nhà máy (Y) như sau:
Ngô (chứa 54% tinh bột) Glucozơ Etanol
Etanol thu được từ quá trình “chế biến” 5 tấn nguyên liệu ngô theo sơ đồ trên có thể pha V m3 xăng sinh học E5 (chứa 95% xăng A92 và 5% etanol về thể tích). Biết etanol có khối lượng riêng là 0,8 g/ml; hiệu suất của mỗi giai đoạn là 80%. Giá trị của V gần nhất với giá trị nào sau đây?

 Xem đáp án
Xem đáp án
C6H10O5 C6H12O6 2C2H5OH (xét 1 mắt xích tinh bột)
\({m_{{C_6}{H_{10}}{O_5}}} = 5.54\% = 2,7\)tấn \( \Rightarrow {n_{{C_6}{H_{10}}{O_5}}} = \frac{1}{{60}}\) \[ \Rightarrow {n_{{C_2}{H_5}OH}} = \frac{1}{{60}}.2.80\% .80\% = \frac{8}{{375}}\]
\[{m_{{C_2}{H_5}OH}} = \frac{8}{{375}}.46 = 0,8.{V_{{C_2}{H_5}OH}} \Rightarrow {V_{{C_2}{H_5}OH}} = \frac{{92}}{{75}}\;{m^3} \to V\]xăng = \[\frac{{{V_{{C_2}{H_5}OH}}}}{{5\% }} = 24,53\]\[{m^3}\]
Câu 36:
Hỗn hợp X gồm K2O, BaO và Al2O3. Hòa tan m gam X vào nước dư, được dung dịch Y và 11,0 gam chất rắn. Sục khí CO2 dư vào Y, thu được 31,2 gam kết tủa. Mặt khác, khi sục từ từ khí CO2 vào Y, đến khi lượng kết tủa đạt cực đại thì số mol CO2 đã phản ứng là 0,3 mol. Giá trị của m là
 Xem đáp án
Xem đáp án
Khi hòa tan X vào nước dư K2O, BaO tan trong nước tạo OH- sau đó Al2O3 + 2OH- ® AlO2- + H2O
Vì sau phản ứng có chất rắn nên Al2O3 dư, OH- hết ® Y gồm AlO2-, K+ (x mol), Ba2+ (y mol)
Sục CO2 dư vào AlO2- thu được kết tủa Al(OH)3: 0,4 mol
Sục 0,3 mol CO2 vào AlO2- thu được kết tủa lớn nhất gồm BaCO3 (y mol) và Al(OH)3 đồng thời muối thu được gồm KHCO3 (x mol)
Bảo toàn C: x + y = 0,3 và bảo toàn điện tích trong Y: x + 2y = 0,4 Þ x = 0,2 và y = 0,1
Bảo toàn Ba, Al, K: nBaO = y = 0,1 mol ; \[{n_{A{l_2}{O_3}}}\] (pư) = 0,4/2 = 0,2 mol ; \[{n_{{K_2}O}}\] = x/2 = 0,1 mol
Þ mX = 45,1 + 11 = 56,1 gam
Câu 37:
Hỗn hợp E gồm ba este đa chức, mạch hở X, Y, Z đều tạo bởi axit cacboxylic với ancol, trong E cacbon chiếm 47% về khối lượng; MX < MY < MZ < 234. Cho 16,34 gam E phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp hai ancol và 18,4 gam hỗn hợp muối khan T (các muối đều no và có số mol bằng nhau) không có khả năng tham gia phản ứng tráng bạc. Phần trăm khối lượng các nguyên tố oxi, hiđro trong T lần lượt là 41,739% và 2,174%. Khối lượng của Z có trong E là
 Xem đáp án
Xem đáp án
Xét muối T chứa: nO = \[\frac{{18,4.41,739\% }}{{16}}\] = 0,48 mol ® nCOONa = 0,24 mol = nNa
và nH = \[\frac{{18,4.2,174\% }}{1}\] = 0,4 mol Þ mC = mT – mO – mNa – mH = 4,8 Þ nC = 0,4 mol
Quy đổi T thành COONa (0,24 mol), C (0,16 mol) và H (0,4 mol)
Các muối đều no và nH > 2nC nên có cả muối đơn chức và đa chức. Mặt khác các muối có cùng số mol và không chứa HCOONa Þ T gồm CH3COONa (0,08 mol) và CH2(COONa)2 (0,08 mol) (giải hệ tìm mol)
Bảo toàn khối lượng: 16,34 + 0,24.40 = 18,4 + mancol Þ mancol = 7,54g
Ta có: nC(E) = \[\frac{{16,34.47\% }}{{12}}\] = 0,64 mol Þ nC (ancol) = 0,64 – (0,24 + 0,16) = 0,24 mol (bảo toàn C)
nOH (ancol) = nNaOH = 0,24 mol ; nhận thấy nC (ancol) = nOH (ancol) Þ hai ancol có dạng CxHy(OH)x
Ta chọn ancol CH3OH và C2H4(OH)2 hoặc CH3OH và C3H5(OH)3
Lập hệ pt hai ẩn liên quan đến nOH và mancol Þ CH3OH (0,1 mol) và C2H4(OH)2 (0,07 mol)
Trường hợp CH3OH và C3H5(OH)3 là trường hợp sai vì E mạch hở và M < 234.
X là CH2(COOCH3)2: a mol
Y là (CH3COO)2C2H4: b mol
Z là CH3COO-CH2-CH2-OOC-CH2-COO-CH3: c mol
\(\left\{ \begin{array}{l}2a + 2b + 3c = {n_{COO}} = 0,24\\a + c = {n_{C{H_2}{{\left( {COONa} \right)}_2}}} = 0,08\\b + c = {n_{{C_2}{H_4}{{\left( {OH} \right)}_2}}} = 0,07\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,02\\b = 0,01\\c = 0,06\end{array} \right.\) Þ mZ = 0,06.204 = 12,24 gam
Câu 38:
Cho các sơ đồ phản ứng sau:
(1)
(2)
(3)
Biết khi đốt cháy muối X trên ngọn lửa đèn cồn cho ngọn lửa màu vàng tươi. Cho các phát biểu sau:
(a) X3 là hợp chất lưỡng tính.
(b) Nhiệt phân hoàn toàn X2 thu được X3.
(c) Dung dịch chất X có môi trường trung tính.
(d) X2 là muối axit và có tính lưỡng tính.
(e) Y là nguyên liệu trong công nghiệp sản xuất thủy tinh và xà phòng.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
2NaCl (X) + 2H2O 2NaOH + H2 + Cl2 (điện phân dung dịch có màng ngăn)
NaOH (X1) + Ba(HCO3)2 NaHCO3 + BaCO3 (Y) + H2O
NaHCO3 (X2) + NaOH Na2CO3 (X3) + H2O
(a) Sai, X3 có tính bazơ.
(b) Đúng, NaHCO3 Na2CO3 (X3) + CO2 + H2O
(c) Đúng.
(d) Đúng.
(e) Sai, Na2CO3 là nguyên liệu trong công nghiệp sản xuất thủy tinh, xà phòng, giấy...
Câu 39:
Hỗn hợp X gồm Fe, Fe2O3, CuO, CuS, FeS2 (trong đó oxi chiếm 16% về khối lượng). Cho 40 gam X tác dụng với dung dịch chứa 1,3 mol H2SO4 thu được dung dịch Y chỉ chứa hai muối (Fe2(SO4)3, CuSO4) và khí SO2 (sản phẩm khử duy nhất). Nhúng thanh Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn lấy thanh Mg làm khô và cân lại thấy khối lượng thanh Mg tăng 12 gam (giả sử toàn bộ kim loại sinh ra bám vào thành Mg). Mặt khác, khi đốt cháy hoàn toàn 10 gam X trong khí O2 dư thu được m gam rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Quy đổi X thành Fe (a mol), Cu (b mol), S (c mol) và O (0,4 mol)
mX = 56a + 64b + 32c + 0,4.16 = 40 (1)
Bảo toàn e: 3a + 2b + 6c = 0,4.2 + \[2{n_{S{O_2}}}\] (2)
Bảo toàn S: 1,3 + c = \(3.\frac{a}{2}\) + b + \[{n_{S{O_2}}}\] (3)
Cho thanh Mg (dư) vào Y: \(\left| \begin{array}{l}3Mg + F{e_2}{(S{O_4})_3} \to 3MgS{O_4} + 2Fe\\Mg + CuS{O_4} \to MgS{O_4} + Cu\end{array} \right.\)
mtăng = mFe + mCu – mMg (pư) = 56a + 64b – 24(\(3.\frac{a}{2}\) + b) = 12 (4)
Từ (1), (2), (3), (4) suy ra: a = 0,4 ; b = 0,1
Khi đốt 10 gam X (giảm 4 lần so với ban đầu) có Fe: 0,1 mol và Cu: 0,025 mol với O2 dư thu được chất rắn gồm Fe2O3 (0,05 mol) và CuO (0,025 mol) ® mrắn = 10 gam.
Câu 40:
Levodopa (L-dopa) là tiền chất của dopamin, thường được sử dụng như một chất thay thế dopamine để điều trị bệnh Parkinson. L-dopa có công thức cấu tạo như hình bên.Cho các phát biểu sau:
(a) L-dopa làm nhạt màu nước brom.
(b) 1 mol L-dopa phản ứng tối đa với 4 mol H2, có xúc tác Ni, to.
(c) L-dopa là một a-amino axit.
(d) Công thức phân tử của L-dopa là C8H11NO4.
(e) 1 mol L-dopa phản ứng tối đa với 3 mol KOH trong dung dịch.
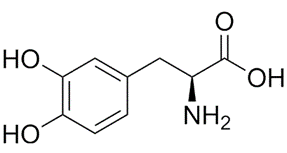
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, do L-dopa có chức phenol.
(b) Sai, 1 mol L-dopa phản ứng tối đa với 3 mol H2, có xúc tác Ni, to.
(c) Đúng.
(d) Sai, Công thức phân tử của L-dopa là C9H11NO4.
(e) Đúng.
