(2023) Đề thi thử Hóa THPT Chuyên Võ Nguyên Giáp, Quảng Bình ( Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Chuyên Võ Nguyên Giáp, Quảng Bình ( Lần 1) có đáp án
-
484 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Glyxin (H2N-CH2-COOH) tác dụng với chất nào dưới đây thu được muối có môi trường axit?
 Xem đáp án
Xem đáp án
Glyxin (H2N-CH2-COOH) tác dụng với HCl thu được muối ClH3N-CH2-COOH có môi trường axit (Cả 2 đầu -NH3Cl và -COOH đều tạo môi trường axit)
Câu 2:
Cho 0,015 mol anilin tác dụng vừa đủ với dung dịch brom. Khối lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
nC6H2Br3NH2 = nC6H5NH2 = 0,015
→ m6H2Br3NH2 = 4,95 gam
Câu 4:
Phát biểu không đúng là
 Xem đáp án
Xem đáp án
C không đúng, trùng hợp buta-1,3-đien thu được polime dùng để sản xuất cao su.
Câu 8:
Cho 0,78 gam hỗn hợp gồm Mg và Al tan hoàn toàn trong dung dịch H2SO4 loãng thu được 0,896 lít khí H2 và dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nSO42- (muối) = nH2 = 0,04
→ m muối = 0,78 + 0,04.96 = 4,62 gam
Câu 13:
Phản ứng của ancol và axit cacboxylic (xúc tác H2SO4 đặc) tạo thành este có tên gọi là
 Xem đáp án
Xem đáp án
Chọn A
Câu 15:
Este X có công thức phân tử C4H6O2. Thủy phân X trong môi trường axit thu được sản phẩm gồm ancol metylic và axit hữu cơ Y. Công thức của Y là
 Xem đáp án
Xem đáp án
X + H2O ⇌ Y + CH3OH
→ X là CH2=CH-COOCH3; Y là CH2=CH-COOH.
Câu 16:
Cho 11,1 gam este đơn chức no E tác dụng hết với 150 ml dung dịch KOH 1M thu được 12,6 gam muối. Công thức cấu tạo của E là
 Xem đáp án
Xem đáp án
mRCOOR’ < nRCOOK ⇔ 11,1/(R + R’ + 44) = 12,6/(R + 83)
Chọn R = 1; R’ = 29 → E là HCOOC2H5
Câu 18:
Lên men dung dịch chứa 225 gam glucozơ, thu được 92 gam ancol etylic. Hiệu suất quá trình lên men là
 Xem đáp án
Xem đáp án
C6H12O6 lên men → 2C2H5OH + 2CO2
nC2H5OH = 2 → nC6H12O6 phản ứng = 1
→ H = 1.180/225 = 80%
Câu 19:
Chất X có vị ngọt, dung dịch X tác dụng được với Cu(OH)2 ở nhiệt độ thường và không tham gia phản ứng tráng bạc. X là
 Xem đáp án
Xem đáp án
Chất X có vị ngọt, dung dịch X tác dụng được với Cu(OH)2 ở nhiệt độ thường và không tham gia phản ứng tráng bạc → Chọn X là saccarozơ.
Câu 21:
Chất nào dưới đây tác dụng với kim loại Na sinh ra khí H2?
 Xem đáp án
Xem đáp án
CH3COOH tác dụng với kim loại Na sinh ra khí H2:
CH3COOH + Na → CH3COONa + ½H2
Câu 27:
Đem khử hoàn toàn m gam hỗn hợp X gồm FeO và CuO cần lượng vừa đủ V lít khí CO. Mặt khác để hòa tan hết m gam hỗn hợp X cần 150 ml dung dịch H2SO4 2M. Giá trị của V là
 Xem đáp án
Xem đáp án
nCO = nO(X) = nH2O = nH2SO4 = 0,3
→ V = 6,72 lít
Câu 28:
Trường hợp nào sau đây không xảy ra phản ứng hóa học?
 Xem đáp án
Xem đáp án
A. Cl2 + FeCl2 → FeCl3
B. H2S + CuCl2 → CuS + HCl
C. Không phản ứng
D. Fe + H2SO4 → FeSO4 + H2
Câu 29:
Trong khí thải công nghiệp thường chứa các khí: SO2, NO2, HF. Có thể dùng chất nào (rẻ tiền) sau đây để loại các khí đó?
 Xem đáp án
Xem đáp án
Dùng Ca(OH)2 để loại các khí trên:
SO2 + Ca(OH)2 → CaSO3 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
HF + Ca(OH)2 → CaF2 + H2O
Câu 30:
Tiến hành các thí nghiệm sau:
(a) Cho Mg dư vào dung dịch FeCl3.
(b) Cho Ba vào dung dịch CuSO4.
(c) Cho Zn vào dung dịch CuSO4.
(d) Nung nóng hỗn hợp Al và Fe2O3 (không có không khí) đến khi phản ứng xảy ra hoàn toàn.
(e) Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch FeCl3.
Số thí nghiệm thu được kim loại là
 Xem đáp án
Xem đáp án
(a) Mg dư + FeCl3 → MgCl2 + Fe
(b) Ba + H2O → Ba(OH)2 + H2
Ba(OH)2 + CuSO4 → Cu(OH)2 + BaSO4
(c) Zn + CuSO4 → ZnSO4 + Cu
(d) Al + Fe2O3 → Al2O3 + Fe
(e) NaOH + FeCl3 → Fe(OH)3 + NaCl
Câu 31:
Một loại etxăng có chứa 4 ankan với thành phần số mol như sau: heptan (10%), octan (50%), nonan (30%) và đecan (10%). Khi dùng loại etxăng này để chạy động cơ ôtô và môtô cần trộn lẫn hơi etxăng và không khí theo tỉ lệ thể tích như thế nào để phản ứng cháy xảy ra vừa hết?
 Xem đáp án
Xem đáp án
Lấy 1 mol etxăng, trong đó có C7H16 (0,1), C8H18 (0,5), C9H20 (0,3) và C10H22 (0,1)
→ nO2 = 0,1.11 + 0,5.12,5 + 0,3.14 + 0,1.15,5 = 13,1
→ n không khí = 5nO2 = 65,5
→ Tỉ lệ thể tích etxăng : không khí = 1 : 65,5
Câu 32:
Hỗn hợp X gồm triglixerit Y, axit oleic, axit panmitic và có tỉ lệ mol tương ứng là 1 : 2 : 3. Đốt cháy hoàn toàn m gam X thu được CO2 và 35,91 gam H2O. Mặt khác, m gam X tác dụng vừa đủ với 240 ml dung dịch NaOH 0,5M, đun nóng thu được glixerol và hỗn hợp chỉ chứa hai muối. Khối lượng của Y trong m gam hỗn hợp X là
 Xem đáp án
Xem đáp án
X gồm triglixerit Y (x mol), axit oleic (2x mol), axit panmitic (3x mol)
→ nNaOH = 3x + 2x + 3x = 0,12 → x = 0,015
Y dạng (C15H31COO)y(C17H33COO)3-yC3H5
nH = 0,015[31y + 33(3 – y) + 5] + 0,015.2.34 + 0,015.3.32 = 1,995.2
→ y = 1
→ m(C15H31COO)(C17H33COO)2C3H5 = 12,87 gam
Câu 33:
Ở điều kiện thường, thực hiện thí nghiệm với khí NH3 như sau: Nạp đầy khí NH3 vào bình thủy tinh rồi đậy bình bằng nắp cao su. Dùng ống thủy tinh vuốt nhọn đầu nhúng vào nước, xuyên ống thủy tinh qua nắp cao su rồi lắp bình thủy tinh lên giá như hình vẽ.
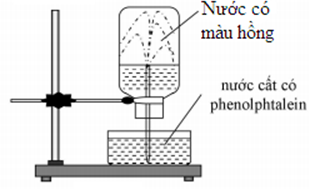
Cho các phát biểu sau liên quan đến thí nghiệm trên:
(a) Thí nghiệm trên để chứng minh tính tan tốt của khí NH3 trong nước.
(b) Tia nước phun mạnh vào bình thủy tinh do áp suất trong bình cao hơn áp suất không khí.
(c) Trong thí nghiệm trên, nếu thay dung dịch phenolphtalein bằng dung dịch quỳ tím thì nước trong bình sẽ không có màu.
(d) So với điều kiện thường, khí X tan trong nước tốt hơn ở 60°C.
(e) Nếu thay thế NH3 bằng HCl thì các hiện tượng xảy ra tương tự.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
(a) Đúng, NH3 tan tốt làm áp suất trong bình giảm dẫn đến nước bị hút lên.
(b) Sai, tia nước phun mạnh vào bình thủy tinh do áp suất trong bình thấp hơn áp suất không khí.
(c) Sai, nếu dùng quỳ tím thì nước trong bình chuyển màu xanh do NH3 có tính kiềm.
(d) Sai, nhiệt độ càng cao, độ tan chất khí càng giảm.
(e) Sai, thay NH3 bằng HCl thì nước cũng bị hút và phun vào bình nhưng phenolphtalein không đổi màu trong môi trường axit.
Câu 34:
Đốt cháy hoàn toàn 0,33 mol hỗn hợp X gồm metyl propionat, metyl axetat và hai hiđrocacbon mạch hở cần vừa đủ 1,27 mol O2, tạo ra 14,4 gam H2O. Nếu cho 0,33 mol X tác dụng với dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là
 Xem đáp án
Xem đáp án
X + a mol H2 → E gồm CxH2xO2 (b mol) và CyH2y+2 (0,33 – b mol)
Nếu đốt E thì cần nO2 = 0,5a + 1,27 và tạo ra nH2O = a + 0,8
nAnkan = nH2O – nCO2
→ nCO2 = (a + 0,8) – (0,33 – b) = a + b + 0,47
Bảo toàn O:
2b + 2(0,5a + 1,27) = 2(a + b + 0,47) + (a + 0,8)
→ nBr2 = a = 0,4
Câu 35:
Cho các phát biểu sau:
(1) Chất béo là trieste của etylen glycol với axit béo.
(2) Các dung dịch protein đều có phản ứng màu biure.
(3) Chỉ có một este đơn chức tham gia phản ứng tráng bạc.
(4) Để điều chế nilon-6 có thể thực hiện phản ứng trùng hợp hoặc trùng ngưng.
(5) Có thể phân biệt glucozơ và fructozơ bằng vị giác.
(6) Thủy phân bất kì chất béo nào cũng thu được glixerol.
(7) Triolein tác dụng được với H2 (xúc tác Ni, t°), dung dịch Br2, Cu(OH)2.
(8) Phần trăm khối lượng nguyên tố hiđro trong tripanmitin là 12,16%.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1) Sai, chất béo là trieste của glyxerol với axit béo.
(2) Đúng
(3) Sai, tất cả este đơn chức của axit fomic đều tráng gương.
(4) Đúng, trùng ngưng NH2-(CH2)5-COOH hoặc trùng hợp caprolactam.
(5) Đúng, fructozơ ngọt hơn rất nhiều so với glucozơ.
(6) Đúng, vì chất béo là trieste của glyxerol với axit béo nên thủy phân bất kì chất béo nào cũng thu được glixerol.
(7) Sai, triolein (C17H33COO)3C3H5 không phản ứng với Cu(OH)2.
(8) Đúng, tripanmitin (C15H31COO)3C3H5 có %H = 12,16%
Câu 36:
Điện phân (với điện cực trơ, màng ngăn) dung dịch chứa x mol CuSO4 và y mol NaCl (x > y) bằng dòng điện một chiều có cường độ 2,68A, sau thời gian t giờ, khối lượng dung dịch Y có khối lượng giảm 20,45 gam so với dung dịch ban đầu. Thêm tiếp Al dư vào Y, thấy thoát ra 3,36 lít khí H2 và dung dịch sau phản ứng chứa 2 chất tan có số mol bằng nhau. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của t gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nSO42- > nNa+ nên 2 chất tan có số mol bằng nhau là Na2SO4 (0,5y) và Al2(SO4)3 (0,5y)
Bảo toàn S → x = 0,5y + 1,5y (1)
TH1: Cu2+ chưa bị điện phân hết
nH2 = 0,15 → nH+ = 0,3 → nO2 = nH+/4 = 0,075
Anot: nCl2 = 0,5y và nO2 = 0,075
Catot: nCu = 0,5y + 0,15
m giảm = 71.0,5y + 0,075.32 + 64(0,5y + 0,15) = 20,45 (2)
(1)(2) → x = 0,2504; y = 0,1252
→ ne = 2(0,5y + 0,15) = It/F → t = 15310s = 4,25h
TH2: Cu2+ đã bị điện phân hết
nH2 = 0,15 → nAl = y = 0,1
(1) → x = 0,2
Catot: nCu = 0,2 và nH2 = a
Anot: nCl2 = 0,05 và nO2 = b
Bảo toàn electron → 0,2.2 + 2a = 0,05.2 + 4b
m giảm = 0,2.64 + 2a + 0,05.71 + 32b = 20,45
→ a = 17/180; b = 11/90
→ ne = 0,2.2 + 2a = It/F → t = 21204s = 5,9h
Câu 37:
Cho sơ đồ các phản ứng sau:
(1) A + X + H2O → Ca(AlO2)2 + H2
(3) Ca(AlO2)2 + CO2 + H2O → G + E
(2) A + H2SO4 → Z + H2
(4) Z + Y → G + Na2SO4
(5) E + Y → CaCO3 + NaHCO3 + H2O
Nhận định về các chất ứng với các chữ cái A, X, Z, G, E như sau:
(a) A là chất có tính lưỡng tính.
(b) X là một bazơ mạnh dùng để sản xuất clorua vôi (CaOCl2), vật liệu xây dựng,
(c) Z là hợp chất có thành phần chính trong phèn chua.
(d) G là hợp chất kết tủa ở dạng keo và có tính lưỡng tính.
(e) E là hợp chất bền không bị phân hủy khi đun nóng và nguyên nhân làm cho nước có tính cứng tạm thời.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
(1)(2) → A là Al
→ X là Ca(OH)2; Z là Al2(SO4)3
(3)(5) → E là Ca(HCO3)2
→ G là Al(OH)3; Y là NaOH
(a) Sai, Al không có tính axit hoặc bazơ.
(b) Đúng
(c) Đúng, phèn chua là K2SO4.Al2(SO4)3.24H2O
(d) Đúng
(e) Sai, E kém bền:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Câu 38:
Cho các phát biểu sau:
(a) Hỗn hợp Cu, Fe3O4 có số mol bằng nhau tan hết trong lượng dung dịch HCl dư.
(b) Cho bột Cu vào lượng dư dung dịch FeCl3, thu được dung dịch chứa hai muối.
(c) Dung dịch amoniac làm phenolphtalein từ không màu chuyển sang màu hồng.
(d) Cho Mg tác dụng với lượng dư dung dịch FeCl3 thu được kim loại Fe.
(e) Kim loại vàng có tính dẻo kém hơn kim loại Al.
(g) Đun nóng có thể làm mềm nước có tính cứng tạm thời.
(f) Cho dung dịch KHSO4 dư vào dung dịch Ba(HCO3)2 thu được 2 kết tủa và 1 khí thoát ra.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng:
Cu + Fe3O4 + 8HCl → CuCl2 + 3FeCl2 + 4H2O
(b) Sai, thu được dung dịch chứa 3 muối là CuCl2, FeCl2, FeCl3 dư:
Cu + FeCl3 → CuCl2 + FeCl2
(c) Đúng, dung dịch NH3 có môi trường kiềm nên làm phenolphtalein từ không màu chuyển sang màu hồng.
(d) Sai: Mg + FeCl3 dư →MgCl2 + FeCl2
(e) Sai, Au dẻo hơn Al
(g) Đúng: M(HCO3)2 → MCO3 + CO2 + H2O
(f) Sai, thu được 1 kết tủa + 1 khí:
KHSO4 + Ba(HCO3)2 → K2SO4 + BaSO4 + CO2 + H2O
Câu 39:
Hòa tan hoàn toàn hỗn hợp X gồm 0,35 mol Mg, 0,1 mol Fe, MgCO3 và Mg(NO3)2 trong hỗn hợp dung dịch chứa 0,05 mol HNO3 và 1,49 mol NaHSO4. Sau khi phản ứng kết thúc, thu được dung dịch Y chỉ chứa 198,21 gam các muối trung hòa và 0,3 mol hỗn hợp khí Z gồm 4 khí không màu không hóa nâu trong không khí và có tỉ khối so với hidro là 539/30. Cho dung dịch NaOH cho đến dư vào dung dịch Y, sau đó lấy lượng kết tủa đun nóng trong không khí đến khối lượng không đổi thu được 32 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Phần trăm về khối lượng của MgCO3 trong hỗn hợp X là
 Xem đáp án
Xem đáp án
32 gam chất rắn gồm Fe2O3 (0,05) → nMgO = 0,6
Khí Z gồm CO2 (a), N2O (b), N2 (c), H2 (d)
nZ = a + b + c + d = 0,3 (1)
mZ = 44a + 44b + 28c + 2d = 0,3.2.539/30 = 10,78 (2)
nMgCO3 = a, bảo toàn Mg → nMg(NO3)2 = 0,25 – a
Bảo toàn N → nNH4+ = 0,55 – 2a – 2b – 2c = 2d – 0,05 (Thế (1) vào)
nH+ = 1,49 + 0,05 = 2a + 10b + 12c + 2d + 10(2d – 0,05) (3)
Bảo toàn H → nH2O = 0,87 – 5d
Bảo toàn khối lượng:
0,35.24 + 0,1.56 + 84a + 148(0,25 – a) + 0,05.63 + 1,49.120 = 198,21 + 10,78 + 18(0,87 – 5d) (4)
(1)(2)(3)(4) → a = 0,2; b = 0,03; c = 0,02; d = 0,05
X gồm Mg (0,35), Fe (0,1), MgCO3 (0,2) và Mg(NO3)2 (0,25 – a = 0,05)
→ %MgCO3 = 43,98%
Câu 40:
Hai chất E và F là đồng phẩn cấu tạo của nhau. Đốt cháy hoàn toàn E (no, mạch hở, ME < 180), thu được số mol CO2 bằng với số mol O2 đã tham gia phản ứng. Từ E, F thực hiện sơ đồ phản ứng sau:
E + NaOH → X + Y (1)
F + NaOH → X + Z + T (2)
Biết: E, F chỉ chứa chức este trong phân tử. Y, T đều là ancol trong đó chỉ có Y hòa tan được Cu(OH)2 và trong Z số nguyên tử cacbon bằng số nguyên tử oxi.
Cho các phát biểu sau:
(a) T tan ít trong nước nhưng tan nhiều trong dung môi hữu cơ.
(b) 1 mol X tác dụng với dung dịch AgNO3 trong NH3 dư, thu được tối đa 2 mol Ag.
(c) E là este no, hai chức, mạch hở.
(d) Có 3 đồng phân cấu tạo thỏa mãn chất Z.
(e) Sục khí propilen vào dung dịch KMnO4, thu được chất hữu cơ Y.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đốt E có nCO2 = nO2 nên E có dạng Cn(H2O)m
Theo các phản ứng thủy phân thì E có ít nhất 4 oxi trong phân tử, ME < 180 → E là C5H8O4
Y là ancol hòa tan được Cu(OH)2 nên E là (HCOO)2C3H6
X là HCOONa; Y là CH3-CHOH-CH2OH
Z có số C bằng số O nên F là:
F có các cấu tạo:
HCOO-CH2-CH2-COO-CH3
HCOO-CH(CH3)-COO-CH3
Z là HO-CH2-CH2-COOH; CH3-CHOH-COOH
T là CH3OH
(a) Sai, T (CH3OH) tan vô hạn trong nước.
(b) Đúng, X (HCOONa hay NaO-CHO) có 1CHO nên 1 mol X cho tối đa 2 mol Ag.
(c) Đúng
(d) Sai, Z có 2 đồng phân cấu tạo thỏa mãn
(e) Đúng: CH3-CH=CH2 + KMnO4 + H2O → CH3-CHOH-CH2OH + KOH + MnO2
