(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (Đề 3)
-
101 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 3:
Nước thải công nghiệp thường chứa các ion kim loại nặng như Hg2+, Pb2+, Fe3+. Để xử lí sơ
bộ và làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng dung dịch chất nào
sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 4:
Dân gian có câu ca dao: “Chẳng thơm cũng thể hoa nhài, dẫu không thanh lịch cũng người Tràng An”. Benzyl axetat, este tạo nên mùi thơm hoa nhài có công thức cấu tạo là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 9:
Kim loại sắt tác dụng với lượng dư chất nào sau đây tạo muối sắt(II)?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 10:
Cho dãy các kim loại: Na, Ca, Cu, Fe, K. Số kim loại trong dãy tác dụng với H2O tạo
dung dịch bazơ là:
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 11:
Mưa acid ảnh hưởng tới hệ thực vật, phá hủy các vật liệu bằng kim loại, các bức tượng bằng đá, gây bệnh cho con người và động vật. Hiện tượng trên gây ra chủ yếu do khí thải của nhà máy nhiệt điện, phương tiện giao thông và sản xuất công nghiệp. Tác nhân chủ yếu trong khí thải gây ra mưa acid là
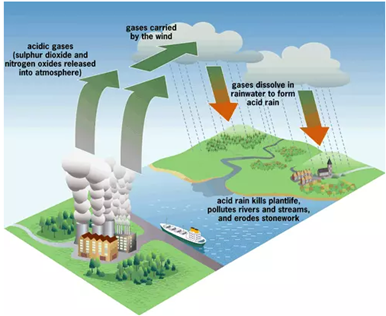
Sơ đồ tạo mưa axit
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 12:
Sự phá huỷ kim loại (không nguyên chất) hay hợp kim do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm sang cực dương gọi là:
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 13:
Metanol là chất rất độc, chỉ một lượng nhỏ vào cơ thể cũng có thể gây mù lòa, lượng lớn hơn có thể gây tử vong. Công thức của metanol là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 14:
Natri hidroxit là hợp chất vô cơ của Natri, tạo ra dung dịch bazơ mạnh khi hoà tan với nước. Natri hidroxit được sử dụng đặc biệt trong các phòng thí nghiệm cũng như trong công nghiệp. Công thức của Natri hidroxit là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 20:
Chất béo là một thành phần cơ bản trong thức ăn của người và động vật, có nhiều trong mô mỡ của động vật, trong một số loại hạt và quả. Công thức nào sau đây là công thức của một chất béo?
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 21:
Cho vào ống nghiệm một vài tinh thể K2Cr2O7, sau đó thêm tiếp khoảng 1ml nước và lắc đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch KOH vào dung dịch X, thu được dung dịch Y. Màu sắc của dung dịch X và Y lần lượt là:
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 22:
Đun nóng dung dịch chứa 27,0 gam glucozơ với lượng dư dung dịch AgNO3 trong NH3, đến khi phản ứng xảy ra hoàn toàn thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
\(\begin{array}{l}{n_{Ag}} = 2{n_{{C_6}{H_{12}}{O_6}}} = 0,3\\ \to {m_{Ag}} = 32,4gam\end{array}\)
Câu 23:
Thủy phân hoàn toàn chất béo E bằng dung dịch NaOH, thu được 1,84 gam glixerol và 18,24 gam muối của axit béo duy nhất. Tên gọi của E là
 Xem đáp án
Xem đáp án
Phản ứng: (RCOO)3C3H5 + 3NaOH → 3RCOONa + C3H5(OH)3.
nC3H5(OH)3 = 0,02 mol ⇒ nRCOONa = 0,06 mol. Biết mRCOONa = 18,24 gam
⇒ MRCOONa = 18,24 ÷ 0,06 = 304 ⇒ Muối là C17H33COONa.
⇒ E là (C17H33COO)3C3H5: triolein.
Câu 25:
Cho Ba kim loại lần lượt vào các dung dịch sau: NaHCO3, CuSO4, (NH4)2CO3, NaNO3, MgCl2. Số dung dịch tạo kết tủa là:
 Xem đáp án
Xem đáp án
Ba + H2O Ba(OH)2 + H2
Ba(OH)2 + 2NaHCO3 BaCO3 $ + Na2CO3 + 2 H2O
Ba(OH)2 + CuSO4 BaSO4 $ + Cu(OH)2$
Ba(OH)2 + (NH4)2CO3 BaCO3 $ + 2NH3 + 2 H2O
Ba(OH)2 + MgCl2 BaCl2 + Mg(OH)2$
Câu 26:
Hòa tan hoàn toàn 4,8 gam Mg trong dung dịch HCl dư, thu được V lít khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
\(\begin{array}{l}Mg + 2HCl \to MgC{l_2} + {H_2}\\ \to {n_{{H_2}}} = {n_{Mg}} = 0,2\end{array}\)
\( \to {V_{{H_2}}} = 4,48\) lít.
Câu 27:
Để trung hòa 30 gam dung dịch của một amin đơn chức X nồng độ 15% cần dùng 100 ml dung dịch HCl 1M. Công thức phân tử X là
 Xem đáp án
Xem đáp án
nHCl = 0,1 (mol) = namin
mamin = 4,5 (gam)
=> Mamin = 45 (g/mol)
Câu 29:
Hòa tan hoàn toàn 8,1 gam kim loại R bằng dung dịch H2SO4 đặc nóng dư,, thu được 4,8 gam chất rắn màu vàng. Kim loại R là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 30:
Este X (C4H8O2) thỏa mãn các điều kiện sau:
X + H2O Y1 + Y2; Y1 + O2 Y2.
X có tên gọi là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 31:
Cho phản ứng sau theo đúng tỉ lệ mol: X + 2NaOH X1 + X2 + X3 + 2H2O. Biết X có công thức phân tử là C5H14O4N2; X1 và X2 là hai muối natri của hai axit cacboxylic đơn chức kế tiếp nhau trong dãy đồng đẳng (); X3 là amin bậc 1. Trong số các phát biểu sau, có bao nhiêu phát biểu sai?
(a) X có ba công thức cấu tạo thỏa mãn các điều kiện trên.
(b) X1 có phản ứng tráng gương.
(c) X2 và X3 có cùng số nguyên tử cacbon.
(d) X là muối của amino axit với amin bậc 1.
 Xem đáp án
Xem đáp án
a) sai vì \[X\,\,la{\o}\,\,HCOO{H_3}NC{H_2}C{H_2}N{H_3}OOCC{H_3}\,\,hoa\"e c\,\,HCOO{H_3}NCH(C{H_3})N{H_3}OOCC{H_3}\,\,\](có 2 CTCT)
d) sai vì X là muối của amin với axit cacboxylic
Câu 32:
Một trong các phương pháp dùng để loại bỏ sắt trong nguồn nước nhiễm sắt là sử dụng lượng vôi tôi vừa đủ để tăng pH của nước nhằm kết tủa ion sắt khi có mặt oxi, theo sơ đồ phản ứng
(1) Fe3+ + OH- → Fe(OH)3 (2) Fe2+ + OH- + O2 + H2O → Fe(OH)3
Một mẫu nước có hàm lượng sắt cao gấp 42 lần so với ngưỡng cho phép là 0,30 mg/l (theo QCVN 01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+ : Fe2+ = 1 : 4. Cần tối thiểu m gam Ca(OH)2 để kết tủa hoàn toàn lượng sắt trong 10 m3 mẫu nước trên. Giá trị của m là
 Xem đáp án
Xem đáp án
nFe3+ + nFe2+ = (0,3.42.10)/56 = 2,25 mol
Fe3+ : Fe2+ = 1 : 4 —> nFe3+ = 0,45 và nFe2+ = 1,8
—> nOH- = 3nFe3+ + 2nFe2+ = 4,95
—> nCa(OH)2 = 2,475 —> mCa(OH)2 = 183,15 gam
Câu 33:
Khi tiến hành thí nghiệm cho mẫu kim loại Na vào cốc H2O (dư) ở nhiệt độ thường có nhỏ thêm vài giọt phenolphtalein. Cho các phát biểu sau:
(a) Mẫu Na bị nóng chảy và chạy trên mặt nước.
(b) Có khí thoát ra xung quanh mẫu Na.
(c) Nước trong cốc từ không màu chuyển sang màu hồng.
(d) Khi tiến hành thí nghiệm không nên lấy mẫu Na quá to có thể gây nổ.
(e) Nếu thay kim loại Na bằng K thì phản ứng xảy ra mãnh liệt hơn.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng
(c) Đúng, phản ứng tạo chất kiềm NaOH nên phenolphtalein chuyển màu hồng.
(d) Đúng, phản ứng xảy ra rất mãnh liệt nên dùng mẩu nhỏ Na để đảm bảo an toàn.
(e) Đúng, K có tính khử mạnh hơn Na nên khử H2O mạnh hơn, có thể gây nổ mạnh
Câu 34:
Trộn 23,76 gam hỗn hợp X gồm Mg, MgO, Fe, FeO, Fe2O3, Fe3O4, Cu và CuO (trong đó nguyên tố oxi chiếm a % theo khối lượng hỗn hợp X) với 2,96 gam Mg(NO3)2, thu được hỗn hợp Y. Hòa tan hoàn toàn Y trong dung dịch chứa đồng thời HCl; 0,025 mol KNO3 và 0,075 mol NaNO3, thu được dung dịch Z chỉ chứa muối clorua và 2,24 lít hỗn hợp khí T gồm N2 và NO. Tỉ khối của T so với H2 là 14,75. Cho Z phản ứng với dung dịch Ba(OH)2 dư trong điều kiện không có không khí, thu được 37,735 gam kết tủa. Giá trị của a gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nMg(NO3)2 = 0,02; T gồm N2 (0,025) và NO (0,075)
Bảo toàn N —> nNH4+ = 0,015
X chứa kim loại (a gam) và O (b mol)
—> a + 16b = 23,76 (1)
nHCl = 12nN2 + 4nNO + 10nNH4+ + 2nO = 2b + 0,75
Z + Ba(OH)2 tạo dung dịch chứa muối KCl (0,025), NaCl (0,075) và BaCl2 (b + 0,325, tính theo bảo toàn Cl)
—> nBa(OH)2 phản ứng = b + 0,325
—> nOH- trong kết tủa = 2(b + 0,325) – nNH4+ = 2b + 0,635
—> a + 0,02.24 + 17(2b + 0,635) = 37,735 (2)
(1)(2) —> a = 21,36; b = 0,15
—> %O = 10,1%
Câu 35:
Hỗn hợp E gồm ba este X, Y, Z đều đa chức, no, mạch hở (MX < MY < MZ). Đốt cháy hoàn toàn 6,84 gam E cần vừa đủ 9,408 gam O2, thu được 4,104 gam H2O. Mặt khác, đun nóng 6,84 gam E với dung dịch NaOH (vừa đủ), cô cạn dung dịch sau phản ứng, thu được muối T (có mạch cacbon không phân nhánh) và hỗn hợp hai ancol (đơn chức, kế tiếp trong dãy đồng đẳng). Đốt cháy hoàn toàn T, thu được Na2CO3, CO2 và 0,864 gam H2O.
Cho các phát biểu sau:
(1) Phân tử khối của Y bằng 146.
(2) Hai ancol tạo thành X, Y, Z là CH3OH và C3H7OH.
(3) Số H của muối T bằng 4.
(4) Cả 3 este X, Y, Z đều là este hai chức.
(5) X, Y, Z là đồng đẳng kế tiếp của nhau.
Số phát biểu đúng là :
 Xem đáp án
Xem đáp án
\({n_{{O_2}}} = 0,294;{n_{{H_2}O}} = 0,228\)
Bảo toàn khối lượng \[ \to {n_{C{O_2}}} = 0,276\]
Ancl đơn và muối không nhánh nên các este đều 2 chức.
\[ \to {n_E} = {n_{C{O_2}}} - {n_{{H_2}O}} = 0,048\]
n muối = 0,048 và \({n_{{H_2}O}}\) đốt muối = 0,048
Số H của muối = 0,048.2/0,048 = 2
\[ \to \]Muối là CH2(COONa)2
\({n_{NaOH}} = 0,096,\) bảo toàn khối lượng \[ \to {m_{Ancol}} = 3,576\]
\({n_{Ancol}} = 0,096 \to {M_{ancol}} = 37,25:C{H_3}OH\) và C2H5OH
X là CH2(COOCH3)2
Y là CH2(COOCH3)(COOC2H5) \[ \to {M_Y} = 146\]
Z là CH2(COOC2H5)2
Câu 36:
Cho các phát biểu sau:
(1) Tơ nilon-6,6 có thể điều chế bằng phản ứng trùng hợp hoặc trùng ngưng.
(2) Trimetylamin là amin bậc ba.
(3) Có thể dùng Cu(OH)2/OH- để phân biệt Ala-Ala và Ala-Ala-Ala
(4) Chất béo lỏng khó bị oxi hóa bởi oxi không khí hơn chất béo rắn.
(5) Metyl metacrylat, glucozơ, triolein đều tham gia phản ứng với nước brom.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1) Sai, Tơ nilon-6,6 điều chế bằng phản ứng trùng ngưng.
(4) Sai, chất béo lỏng chứa C=C ở gốc axit nên dễ bị oxi hóa bởi O2 không khí hơn chất béo rắn.
Câu 37:
Một mẫu nước thải của nhà máy sản xuất X có pH = 4. Để thải ra ngoài môi trường theo đúng qui định thì cần phải điều chỉnh pH nằm trong khoảng từ 6,5 đến 7,5 nên nhà máy thường sử dụng vôi sống để xử lí. Khối lượng vôi sống cần dùng cho 1m³ nước để nâng pH của nước thải từ 4 lên 7 là (Giả thiết chỉ xảy ra phản ứng giữa ion H+ và OH– cũng như bỏ qua sự thủy phân của các muối nếu có)
 Xem đáp án
Xem đáp án
Đổi 1 m3 = 1000 (l)
pH = 4 => [H+] = 10-4 (M)
nH+ = 10-4.1000 = 0,1 (mol)
Để pH = 7 (môi trường trung tính) thì H+, OH- phản ứng vừa đủ.
Gọi số mol vôi sống cần dùng là x (mol)
CaO + H2O Ca(OH)2
Ca(OH)2 Ca2+ + 2OH-
x 2x (mol)
H+ + OH- ![]() H2O
H2O
0,1 = 2x => x = 0,05 (mol) => mCaO = 56.0,05 = 2,8 gam
Câu 38:
Điện phân dung dịch X gồm CuSO4 và KCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện 0,5A, hiệu suất điện phân là 100%. Lượng kim loại thoát ra ở catot và lượng khí sinh ra từ bình điện phân được cho theo bảng sau:
|
Thời gian điện phân (giây) |
t |
2t |
t + 67550 |
|
Lượng kim loại Cu sinh ra ở catot (gam) |
0,75a |
a |
a |
|
Lượng khí thoát ra từ bình điện phân (lít) |
1,68 |
V |
8,4 |
Tại thời điểm (t + 67550) giây, lượng Cu sinh ra ở catot đủ để mạ lên mặt sau của một chiếc gương hình tròn, bán kính 15 cm, độ dày lớp mạ 1,01.10-3 cm. Biết khối lượng riêng của Cu là 8,96 g/cm³. Dung dịch sau điện phân tại thời điểm 2t giây có khả năng hoà tan m gam Al. Giá trị của m là:
 Xem đáp án
Xem đáp án
nCu = a/64 = π.R².1,01.10-3.8,96/64 = 0,1 mol
• Lúc t giây: nCu = 0,075; n khí anot = 0,075 —> Chỉ có khí Cl2.
• Trong khoảng từ t đến t + 67550 thì ne = 0,5.67550/F = 0,35
nCu = 0,025 —> nH2 = 0,15
n khí anot = 0,375 – 0,075 – 0,15 = 0,15 < ne/2 nên đã có O2
nCl2 = u; nO2 = v —> u + v = 0,15
và 2u + 4v = 0,35
—> u = 0,125; v = 0,025
nCl2 tổng = 0,075 + 0,125 = 0,2
• Lúc 2t giây ne = 0,075.2.2 = 0,3 —> Cl2 chưa thoát ra hết, H2O bị điện phân bên catot
Anot: nCl2 = 0,3/2 = 0,15
Catot: nCu = 0,1 —> nH2 = 0,05
H2O + 2e —> H2 + 2OH-
0,05 0,1 mol
Al + OH- + H2O —> AlO2- + 3/2H2
0,1 0,1 (mol) => mAl = 2,7 gam
Câu 39:
Xăng sinh học E5 chứa 5% ethanol về thể tích (d = 0,8g/ml), còn lại là xăng truyền thống, giả thiết xăng truyền thống chỉ chứa hai ankan là C8H18 và C9H20 (có tỉ lệ mol tương ứng là 1 : 2; d = 0,7g/ml). Khi được đốt cháy hoàn toàn, 1 mol ethanol tỏa ra lượng nhiệt là 1365 kJ, 1 mol C8H18 tỏa ra lượng nhiệt là 5072 kJ và 1 mol C9H20 tỏa ra nhiệt lượng là 6119 kJ. Trung bình, một chiếc xe máy di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 212 kJ. Nếu xe máy đó đã sử dụng hết 5 l xăng E5 ở trên thì quãng đường xe di chuyển được gần nhất với giá trị nào sau đây (biết hiệu suất sử dụng nhiên liệu của động cơ là 30%)
 Xem đáp án
Xem đáp án
nC2H5OH = 5000.5%.0,8/46 = 4,3478 mol
nC8H18 = 4x; nC9H20 = 3x
⟶ 5000.95%.0,7 = 114.x + 128.2x ⟶ x = 8,9864
Xe chạy được y km thì hết 5 l xăng, bảo toàn năng lượng:
(4,3478.1365 + 5072.x + 6119.2x).30% = 212y
⟶ y ≈ 228 km
Câu 40:
Một số loại máy đo nồng độ cồn trong hơi thở dựa trên phản ứng của ethanol (cồn) (C2H5OH) có trong hơi thở với hợp chất potassium dichromate trong môi trường sulfuric acid loãng. Phản ứng (chưa được cân bằng) như sau:
C2H5OH + K2Cr2O7 + H2SO4 CH3COOH + Cr2(SO4)3 + K2SO4 + H2O (1)
Dung dịch chứa ion Cr2O72- ban đầu có màu da cam, khi xảy ra phản ứng (1) dưới tác dụng của chất xúc tác ion Ag+ tạo thành sản phẩm là dung dịch chứa ion Cr3+ có màu xanh lá cây trong khoảng chưa đến 1,0 phút. Dựa vào sự thay đổi màu sắc này có thể xác định người tham gia giao thông có sử dụng thức uống có cồn hay không. Bảng sau (trích từ nghị định 46/2016/NĐ-CP) đưa ra mức độ phạt người tham gia giao thông có sử dụng hàm lượng cồn.

Hình ảnh thổi nồng độ cồn.
|
Mức độ vi phạm |
≤ 0,25 mg cồn / 1 lít khí thở |
0,25 – 0,4 mg cồn / 1 lít khí thở |
> 0,4 mg cồn / 1 lít khí thở |
|
Xe máy |
2.000.000 - 3.000.000 triệu đồng |
4.000.000 – 5.000.000 triệu đồng |
6.000.000 - 8.000.000 triệu đồng |
Một mẫu hơi thở của người bị nghi vấn có sử dụng cồn khi tham gia giao thông có thể tích 52,5 ml được thổi vào thiết bị Breathalyzer chứa 2,0 ml dung dịch K2Cr2O7 nồng độ 0,056 mg/ml trong môi trường acid H2SO4 50% và nồng độ ion Ag+ ổn định 0,25 mg/ml. Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ dung dịch màu da cam chuyển hoàn toàn thành màu xanh lá cây. Hỏi người này có vi phạm pháp luật không? Nếu có, thì mức đóng phạt là bao nhiêu?
 Xem đáp án
Xem đáp án
C2H5OH + K2Cr2O7 + H2SO4 CH3COOH + Cr2(SO4)3 + K2SO4 + H2O
Chất oxi hóa: K2Cr2O7 ; Chất khử: C2H5OH
![]() \[\begin{array}{l}3x\,\,\,\,\,\,\,\,\,\,\,\mathop {2C}\limits^{ - 2} \to 2\mathop C\limits^0 + 4e\\\,2x\,\,\,\,\,\,\,\,\,\,\mathop {2C}\limits^{ + 6} r + 6e \to \mathop {2C}\limits^{ + 3} r\end{array}\]
\[\begin{array}{l}3x\,\,\,\,\,\,\,\,\,\,\,\mathop {2C}\limits^{ - 2} \to 2\mathop C\limits^0 + 4e\\\,2x\,\,\,\,\,\,\,\,\,\,\mathop {2C}\limits^{ + 6} r + 6e \to \mathop {2C}\limits^{ + 3} r\end{array}\]
3C2H5OH + 2K2Cr2O7 + 8H2SO4 3CH3COOH +2Cr2(SO4)3 + 2K2SO4 + 11H2O
nK2Cr2O7 = 2.(0,056.10-3/294)= 3,81.10-7 mol .
nC2H6O = 3/2 nK2Cr2O7 = 5,71.10-7 mol.
mC2H6O = 2,63.10-5 gam / 52,5 ml hơi thở.
Trong 1000 ml hơi thở có: (1000.2,63.10-3/52,5)=5,007.10-4 gam C2H5OH
Hay: 0,5007 mg C2H5OH > 0,4 mg à Vi phạm luật giao thông.
Đối chiếu bảng: 0,5007 > 0,4 mg à Mức phạt từ 6 đến 8 triệu đồng.
