(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (23)
-
105 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Thành phần chính của đá vôi là canxi cacbonat. Công thức hóa học của canxi cacbonat là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 10:
Cho thanh kim loại Zn vào dung dịch chất nào sau đây sẽ xảy ra hiện tượng ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 11:
Cr2O3 được dùng để tạo màu lục cho đồ sứ và thuỷ tinh. Tên gọi của Cr2O3 là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 18:
Ở điều kiện thường, oxit kim loại nào sau đây không phản ứng với nước?
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 19:
Trộn bột kim loại X với bột oxit của sắt (gọi là hỗn hợp tecmit) thực hiện phản ứng nhiệt nhôm dùng để hàn đường ray tàu hỏa. Kim loại X là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 20:
Chất khí X gây ra hiệu ứng nhà kính và tham gia vào quá trình quang hợp của cây xanh tạo tinh bột. Chất khí X là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 22:
Hòa tan m gam hỗn hợp X gồm Al và Na (có số mol bằng nhau) vào nước dư, thu được 4,48 lít khí (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 23:
Cho các loại tơ sau: xenlulozơ axetat, nilon-7, nitron, visco, tơ nilon-6,6. Số tơ thuộc loại poliamit là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 24:
Hòa tan hoàn toàn 1,6 gam Cu bằng dung dịch HNO3, thu được x mol NO2 (là sản phẩm khử duy nhất của N+5). Giá trị của x là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 25:
Thủy phân hoàn toàn 0,2 mol etyl axetat trong dung dịch NaOH, thu được m gam ancol. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 28:
Thủy phân hoàn toàn 36,5 gam đipeptit mạch hở Gly-Ala trong dung dịch KOH (vừa đủ) thu được dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 30:
Cho các phát biểu sau:
(a) Khi bị oxi hóa chất béo cung cấp năng lượng cho cơ thể nhiều hơn chất đạm và chất bột.
(b) Dùng nước brom phân biệt được hai dung dịch fructozơ và glucozơ.
(c) Số nhóm -OH trong phân tử saccarozơ là 8.
(d) Thủy phân hoàn toàn protein đơn giản thu được b-amino axit.
(e) Trong phân tử cao su buna-S có chứa nguyên tố lưu huỳnh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng.
(b) Đúng.
(c) Đúng.
(d) Sai, thủy phân hoàn toàn protein đơn giản thu được a-amino axit.
(e) Sai, trong phân tử cao su buna-S có chứa thành phần nguyên tố C và H.
Câu 31:
Hoà tan hết Fe3O4 trong dung dịch H2SO4 loãng dư, thu được dung dịch X. Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Hoà tan hết Fe3O4 trong dung dịch H2SO4 loãng dư, thu được dung dịch X gồm FeSO4, Fe2(SO4)3, H2SO4 dư.
A. Đúng, cho NaOH dư vào X, ban đầu có kết tủa Fe(OH)2 trong không khí chuyển dần sang Fe(OH)3.
B. Đúng, FeSO4 + KMnO4 + H2SO4 ® Fe2(SO4)3 + MnSO4 + K2SO4 + H2O (mất màu dung dịch thuốc tím).
C. Đúng.
D. Sai, X có Fe2(SO4)3 + Cu ® CuSO4 + FeSO4.
Câu 32:
Nhúng thanh Mg có khối lượng m gam vào 200 ml dung dịch X chứa Fe(NO3)3 0,2M và Cu(NO3)2 0,15M, sau khi các phản ứng xảy ra hoàn toàn, lấy thanh Mg ra rồi rửa sạch cân lại thấy khối lượng tăng thêm 1,36 gam so với m gam ban đầu. Giả thiết rằng thể tích dung dịch không đổi sau phản ứng và toàn bộ kim loại sinh ra bám lên thanh Mg. Giá trị của m là
 Xem đáp án
Xem đáp án
(1) Mg + 2Fe3+ ® Mg2+ + 2Fe2+ (thanh Mg giảm m1 = 24nMg)
(2) Mg + Cu2+ ® Mg2+ + Cu (thanh Mg tăng m2 = 64nCu – 24nMg)
(3) Mg + Fe2+ ® Mg2+ + Fe (thanh Mg tăng m3 = 56nCu – 24nMg)
Vì khối lượng thanh Mg tăng nên sau phản ứng có sự tạo thành kim loại
Trường hợp 1: xảy ra phản ứng (1), (2)
1,36 = m2 – m1 = (64 – 24)x – 24.0,02 Þ x = 0,046 > 0,03 (Mg còn dư để tiếp tục xảy ra pư (3)): vô lí
Trường hợp 2: xảy ra cả 3 phản ứng
1,36 = m3 + m2 – m1 = (56 – 24)x + (64 – 24).0,03 – 24.0,02 Þ x = 0,02
Vậy mMg = (0,02 + 0,03 + 0,02).24 = 1,68 gam.
Câu 33:
Thực hiện các thí nghiệm sau :
(a) Đun sôi nước cứng tạm thời.
(b) Cho phèn chua vào lượng dư dung dịch Ba(OH)2.
(c) Sục a mol khí CO2 vào dung dịch chứa a mol Ca(OH)2.
(d) Cho 2a mol NaOH vào dung dịch chứa a mol Ca(H2PO4)2.
(e) Cho dung dịch NH3 tới dư vào dung dịch FeCl3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
(a) Ca(HCO3)2, Mg(HCO3)2 CaCO3, MgCO3¯ + CO2 + H2O
(b) Ba2+ + SO42- ® BaSO4¯
(c) CO2 + Ca(OH)2 ® CaCO3¯ + H2O.
(d) 2NaOH + Ca(H2PO4)2 ® CaHPO4¯ + Na2HPO4 + 2H2O
(e) FeCl3 + 3NH3 + 3H2O ® Fe(OH)3¯ + 3NH4Cl
Câu 34:
Nguyên lý hoạt động của máy đo nồng độ cồn dựa trên sự chuyển đổi màu của crom(VI) oxit để xác định nồng độ cồn trong hơi thở của người sử dụng theo phản ứng sau:
CrO3 + C2H5OH Cr2O3 + CH3COOH + H2O
Mức phạt vi phạm nồng độ cồn khi lái xe được quy định tại Nghị định 123/2021/NĐ-CP cụ thể như sau:
|
Mức |
1 |
2 |
3 |
|
Hàm lượng (mg etanol/100 ml máu) |
< 50 |
50 – 80 |
> 80 |
|
Phạt với xe máy (GPLX: giấy phép lái xe) |
2–3 triệu đồng và tước GPLX 10-12 tháng |
4–5 triệu đồng và tước GPLX 16-18 tháng |
6–8 triệu đồng và tước GPLX 22-24 tháng |
Một mẫu hơi thở của một người đi xe máy bị nghi vấn có sử dụng cồn khi tham gia giao thông có thể tích 50 ml được thổi vào máy đo có chứa 0,04 gam crom(VI) oxit. Hàm lượng etanol của người lái xe trong mẫu trên thuộc mức phạt nào?
 Xem đáp án
Xem đáp án
4CrO3 (màu đỏ thẫm) + 3C2H5OH 2Cr2O3 (màu xanh đen) + 3CH3COOH + 3H2O
Trong 50 ml có 13,8 mg C2H5OH Þ trong 100 ml có 27,6 mg C2H5OH
Vậy người đó đã vi phạm nồng độ cồn và nằm trong mức phạt 1.
Câu 35:
Từ chất hữu cơ X (C5H14O4N2) thực hiện phản ứng sau (theo đúng tỉ lệ mol):
X + 2NaOH X1 + X2 + X3 + 2H2O
Biết X1 và X2 là hai muối natri của hai axit cacboxylic đơn chức kế tiếp nhau trong dãy đồng đẳng ( ), X3 là amin bậc một và có mạch cacbon không phân nhánh.
Cho các phát biểu sau:
(a) Chất X có hai công thức cấu tạo thỏa mãn.
(b) Chất X1 có phản ứng tráng bạc.
(c) Chất X2 được dùng để điều chế khí metan trong công nghiệp.
(d) X3 là chất khí ở điều kiện thường.
(e) Các chất X2 và X3 có cùng số nguyên tử cacbon.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
X là: HCOO-NH3-CH2-CH2-NH3-OOC-CH3
X1 là HCOONa; X2 là CH3COONa và X3 là NH2-CH2-CH2-NH2
(a) Sai, X có một công thức cấu tạo thỏa mãn.
(b) Đúng.
(c) Sai, X2 được dùng để điều chế khí metan trong phòng thí nghiệm.
(d) Sai, X3 là chất lỏng.
(e) Đúng.
Câu 36:
Hỗn hợp E gồm ba este X, Y, Z (MX < MY < MZ) đều mạch hở, chỉ chứa một loại nhóm chức; trong phân tử mỗi este có số liên kết π không quá 3. Cho 44,56 gam E tác dụng vừa đủ với 0,74 mol NaOH trong dung dịch, thu được hỗn hợp G chứa ba ancol no có tỉ khối hơi so với H2 bằng 28,75 và m gam hỗn hợp F gồm các muối. Đốt cháy hoàn toàn m gam F cần dùng 0,46 mol O2, thu được Na2CO3 và 0,86 mol hỗn hợp gồm CO2 và H2O. Biết rằng trong E, X chiếm 50% về số mol của hỗn hợp. Phần trăm khối lượng của Y trong E là
 Xem đáp án
Xem đáp án
Xét phản ứng đốt Y, đặt a, b là số mol CO2 và H2O Þ a + b = 0,86
Bảo toàn O: 2a + b + 0,37.3 = 0,74.2 + 0,46.2 (với \[n{}_{N{a_2}C{O_3}}\] = nNaOH/2 = 0,37 mol, nCOONa = 0,74 mol)
Þ a = b = 0,43 khi đó các muối trong Y đều no, đơn chức (đốt tạo CO2 và H2O có mol bằng nhau).
Bảo toàn khối lượng: mF = 0,43.44 + 0,43.18 + 0,37.106 – 0,46.32 = 25,58 gam
Bảo toàn khối lượng: mE + mNaOH = mF + mG Þ mG = 23 gam Þ nG = 0,4 mol
Các ancol và muối đều no nên X gồm các este no, mạch hở, không quá 3 chức. Quy đổi X thành:
HCOOCH3: x mol , (HCOO)2C2H4: y mol , (HCOO)3C3H5: z mol , CH2: t mol
Ta có: \(\left\{ {\begin{array}{*{20}{l}}\begin{array}{l}x + y + z = 0,4\\x + 2y + 3z = 0,74\end{array}\\{x = y + z}\end{array}} \right.\) Þ x = 0,2; y = 0,06 và z = 0,14
Từ mX = 44,56 gam Þ \[{m_{C{H_2}}}\]= 0,84 gam Þ t = 0,06 mol
Dễ thấy t = y, vậy chỉ có thêm 1 nhóm CH2 trong chất này. Các este gồm:
HCOOCH3: 0,2 mol
HCOO-C2H4-OOC-CH3: 0,06 mol ứng với %m = 17,7%
(HCOO)3C3H5: 0,14 mol
Câu 37:
Cho V ml dung dịch Ba(OH)2 0,1M vào dung dịch NaHCO3, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 1M vào X, sự phụ thuộc số mol khí vào thể tích dung dịch HCl được mô tả như đồ thị hình sau:
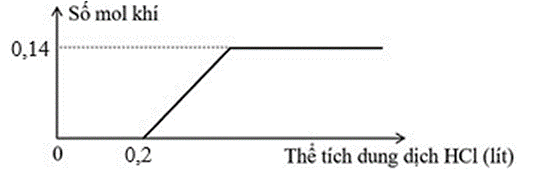
Giá trị của V là
 Xem đáp án
Xem đáp án
Từ đồ thị ta thấy nHCl khi bắt đầu tạo khí lớn hơn số mol khí thoát ra Þ X gồm Na2CO3 (0,14 mol) và NaOH (0,2 – 0,14 = 0,06 mol)
(PTHH:
Cho Ba(OH)2 tác dụng với NaHCO3 thu được Na2CO3, NaOH và BaCO3
BT Na: \[{n_{NaHC{O_3}}}\] = 0,14.2 + 0,06 = 0,34 mol
BT C: 0,34 = 0,14 + nBaCO3 Þ \[{n_{BaC{O_3}}}\] = 0,2 mol
BT Ba: \[{n_{Ba{{\left( {OH} \right)}_2}}}\] = 0,2 mol Þ V = 200 ml
Câu 38:
Cho 28,56 gam hỗn hợp X gồm Fe, Fe3O4 và FeCO3 tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch Y và 3,024 lít (đktc) hỗn hợp khí có tỉ khối so với H2 là 15. Cho Y tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được 138,405 gam kết tủa. Mặt khác, hòa tan hoàn toàn m gam X trong dung dịch H2SO4 đặc, nóng, dư thu dược 1,1 mol hỗn hợp khí gồm CO2 và SO2 (là sản phẩm khử duy nhất của S+6). Giá trị của m là
 Xem đáp án
Xem đáp án
Khí Y gồm CO2 (0,09 mol) và H2 (0,045 mol)
Quy đổi X thành Fe (a mol), O (b mol) và CO2 (0,09 mol) Þ mX = 56a + 16b + 0,09.44 = 28,56 (1)
Bảo toàn H: nHCl = \[2{n_{{H_2}O}}{\rm{ }} + {\rm{ }}2{n_{{H_2}}}\] = 2b + 0,09
Bảo toàn e cho cả quá trình: 3a = 2b + 2\[{n_{{H_2}}}\] + nAg Þ nAg = 3a – 2b – 0,09
m↓ = mAg + mAgCl = 143,5(2b + 0,09) + 108(3a – 2b – 0,09) = 138,405 (2)
Từ (1), (2) suy ra: a = 0,345 mol; b = 0,33 mol
Nếu hòa tan 28,56 gam X vào H2SO4 (đặc, nóng, dư) thì theo bảo toàn e:
3a = 2b + \[2{n_{S{O_2}}}\] Þ \[{n_{S{O_2}}}\] = 0,1875 mol Þ \[{n_{C{O_2}}} + {\rm{ }}{n_{S{O_2}}}\] = 0,2775
Nếu hòa tan m gam X vào H2SO4 (đặc, nóng, dư) thì \[{n_{C{O_2}}} + {\rm{ }}{n_{S{O_2}}}\] = 1,1 (gấp 4 lần so với 28,56 gam)
Þ m = 28,56.4 = 114,24 gam.
Câu 39:
Tiến hành thí nghiệm thử tính chất của glixerol và etanol với đồng(II) hiđroxit theo các bước sau:
Bước 1: Cho vào hai ống nghiệm, mỗi ống khoảng 3 – 4 giọt dung dịch CuSO4 2% và 2 – 3 ml dung dịch NaOH 10%, lắc nhẹ.
Bước 2: Nhỏ 2 – 3 giọt glixerol vào ống nghiệm thứ nhất, 2 – 3 giọt etanol vào ống nghiệm thứ hai. Lắc nhẹ cả hai ống nghiệm.
Cho các phát biểu sau về thí nghiệm đã tiến hành ở trên:
(a) Sau bước 1, trong cả hai ống nghiệm đều có kết tủa màu xanh.
(b) Sau bước 2, trong ống nghiệm thứ hai thu được dung dịch màu xanh thẫm.
(c) Thí nghiệm trên, được dùng để phân biệt etanol và glixerol.
(d) Sau bước 2, trong ống nghiệm thứ nhất vẫn còn kết tủa của đồng(II) hiđroxit.
(e) Có thể thay etanol bằng etylen glicol thì hiện tượng xảy ra tương tự.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Bước 1: CuSO4 + 2NaOH → Cu(OH)2↓(xanh lam) + Na2SO4
Bước 2: Ống 1: Kết tủa tan tạo thành dung dịch màu xanh lam của muối đồng (II) glixerat
PTHH: 2C3H5(OH)3 + Cu(OH)2→ [C3H5(OH)2O]2Cu + 2H2O
Ống 2: không có hiện tượng, kết tủa không tan.
Þ Các ý a, b, c, d đúng. Ý (e) sai vì etylen glicol có thể hòa tan được Cu(OH)2 giống glixerol.
Câu 40:
Người ta điều chế nhôm bằng phương pháp điện phân nóng chảy oxit nhôm (Al2O3) với điện cực bằng than chì. Biết rằng khí thoát ra ở anot có 10% oxi, 10% cacbon monooxit và 80% cacbon đioxit (về thể tích). Cho các phản ứng xảy ra hoàn toàn. Để sản xuất 27 tấn nhôm (Al) thì khối lượng than chì làm anot bị tiêu hao gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Theo đề: nAl = 1 và anot gồm các khí O2 (0,1x), CO (0,1x) và CO2 (0,8x)
2Al2O3 4Al + 3O2
1 0,75
Bảo toàn nguyên tố O: 0,75.2 = 0,1x.2 + 0,1x + 0,8x.2 Þ x = 15/19
Bảo toàn nguyên tố C: nC = 0,1x + 0,8x = 27/38 Þ mC = 8,53 tấn
