(2023) Đề thi thử Hóa THPT Yên Thành, Nghệ An (Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Yên Thành, Nghệ An (Lần 1) có đáp án
-
422 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 3:
Chất nào sau đây là muối trung hòa?
 Xem đáp án
Xem đáp án
NaCl là muối trung hòa do gốc axit không còn khả năng nhường proton.
Chọn A
Câu 4:
Trong y tế, khí X được hóa lỏng dùng để làm chất duy trì hô hấp cho bệnh nhân. Khí X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 5:
Khi làm thí nghiệm với dung dịch H2SO4 đặc thường sinh ra khí lưu huỳnh dioxit làm ô nhiễm không khí. Công thức của lưu huỳnh đioxit là
 Xem đáp án
Xem đáp án
Chọn B
Câu 6:
Cho các loại tơ: tơ visco, tơ tằm, tơ olon, tơ nilon-6, tơ nilon-6,6. Số tơ có chứa nguyên tố nitơ là:
 Xem đáp án
Xem đáp án
Các tơ có chứa nguyên tố nitơ là: tơ tằm, tơ olon, tơ nilon-6, tơ nilon 6,6.
Chọn D
Câu 7:
Cho Zn tác dụng với HCl trong dung dịch tạo thành khí H2 và muối X. Chất X là
 Xem đáp án
Xem đáp án
Chất X là ZnCl2:
Zn + 2HCl —> ZnCl2 + H2
Chọn D
Câu 8:
Chất nào sau đây là amino axit?
 Xem đáp án
Xem đáp án
H2NCH2COOH là amino axit vì phân tử có 2 loại nhóm chức -NH2 và -COOH.
Chọn B
Câu 10:
X là kim loại có khối lượng riêng lớn nhất trong tất cả các kim loại. X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 12:
Một trong những loại thuốc kháng axit dùng để hỗ trợ bệnh nhân chữa trị bệnh đau dạ dày là Gastropulgite. Thành phần của loại thuốc này chứa nhôm hiđroxit và magie cacbonat. Công thức của Magie cacbonat là
 Xem đáp án
Xem đáp án
Chọn C
Câu 13:
Chất nào sau đây có tính chất lưỡng tính?
 Xem đáp án
Xem đáp án
NaHCO3 có tính chất lưỡng tính vì nó vừa có khả năng nhường proton, vừa có khả năng nhận proton:
NaHCO3 + NaOH —> Na2CO3 + H2O
NaHCO3 + HCl —> NaCl + CO2 + H2O
Chọn A
Câu 14:
Ở điều kiện thích hợp, N2 thể hiện tính khử trong phản ứng với
 Xem đáp án
Xem đáp án
Ở điều kiện thích hợp, N2 thể hiện tính khử trong phản ứng với O2:
N2 + O2 —> 2NO (t° cao, số oxi hóa của N tăng từ 0 lên +2 nên N2 là chất khử).
Khi N2 phản ứng với Li, H2, Mg thì số oxi hóa của N giảm từ 0 xuống -3 (N2 là chất oxi hóa)
Chọn A
Câu 17:
Oxit nào sau đây tan hoàn toàn trong nước dư tạo thành dung dịch kiềm?
 Xem đáp án
Xem đáp án
K2O tan hoàn toàn trong nước dư tạo thành dung dịch kiềm:
K2O + H2O —> 2KOH
Các oxit còn lại không tan trong nước.
Chọn B
Câu 19:
Cho vào ống nghiệm 1 ml dung dịch AgNO3 1%, sau đó nhỏ từ từ dung dịch NH3, đồng thời lúc đều cho đến khi kết tủa sinh ra bị hòa tan hết. Thêm tiếp vài giọt dung dịch chất X, sau đó đun nóng nhẹ thì thấy thành ống nghiệm sáng bóng như gương. Chất X có thể là
 Xem đáp án
Xem đáp án
Chọn A
Câu 20:
Thủy phân tristearin ((C17H35COO)3C3H5) trong dung dịch NaOH, thu được muối có công thức là
 Xem đáp án
Xem đáp án
(C17H35COO)3C3H5 + 3NaOH —> 3C17H35COONa + C3H5(OH)3
Muối thu được là C17H35COONa.
Chọn B
Câu 21:
Cho các chất sau: glyxin, etylmetylamin, anbumin, Ala-Ala. Có bao nhiêu chất tác dụng được với dung dịch NaOH?
 Xem đáp án
Xem đáp án
Có 3 chất tác dụng được với dung dịch NaOH là: glyxin, anbumin, Ala-Ala
Chọn B
Câu 22:
Kim loại nào sau đây chỉ điều chế được bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
K có tính khử rất mạnh nên chỉ điều chế được bằng phương pháp điện phân nóng chảy.
Chọn C
Câu 23:
Hoà tan Fe trong dung dịch HNO3 dư được dung dịch X. Cho các chất: Cu, Fe(NO3)2, NaOH, Fe2(SO4)3 có bao nhiêu chất tác dụng được với dung dịch X?
 Xem đáp án
Xem đáp án
X chứa Fe(NO3)3, HNO3 dư. Có 3 chất tác dụng được với X là Cu, Fe(NO3)2, NaOH.
Chọn C
Câu 24:
Ở nhiệt độ thưởng, chất nào sau đây không làm mất màu dung dịch Br2?
 Xem đáp án
Xem đáp án
Propan no, mạch hở nên không làm mất màu dung dịch Br2 ở nhiệt độ thường.
Các chất còn lại có C=C nên làm mất màu dung dịch Br2.
Chọn B
Câu 25:
Cho m gam glucozơ tác dụng hết với lượng dư dung dịch AgNO3 trong NH3, thu được 0,4 mol Ag. Lên men m gam glucozơ tạo etanol (hiệu suất của quá trình 75%) và V lít CO2. Giá trị của V là
 Xem đáp án
Xem đáp án
2Ag ← C6H12O6 → 2CO2
—> nCO2 = 0,4.75% = 0,3 —> V = 6,72 lít
Chọn B
Câu 26:
Vanilin là hợp chất thiên nhiên, được sử dụng rộng rãi với chức năng là chất phụ gia bổ sung hương thơm trong các loại đồ ăn, đồ uống, bánh kẹo, nước hoa… Vanillin có công thức cấu tạo như sau:
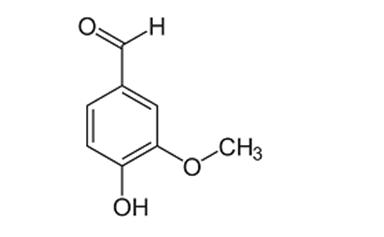
Nhận định nào sai về vanilin?
 Xem đáp án
Xem đáp án
A. Đúng, vanilin có 19 liên kết xichma (σ).
Vanilin là C8H8O3, có 7C-H, 4C-O, 1O-H, 7C-C
B. Sai, vanilin có 3 loại nhóm chức: phenol, anđehit và ete.
C. Đúng, vanilin có -CHO nên phản ứng được với dung dịch AgNO3 trong NH3 khi đun nóng.
D. Đúng, CTPT và CTĐGN đều là C8H8O3
Chọn B
Câu 27:
Cho các phát biểu sau:
(a) Cao su thiên nhiên có thành phần chính là isopren.
(b) Xenlulozơ không tan trong nước nhưng tan nhiều trong nhiều dung môi hữu cơ thông thường.
(c) Lipit bao gồm chất béo, sáp, steroit, photpho lipit.
(d) Poli (metyl metacrylat) được dùng làm thuỷ tinh hữu cơ.
(e) Poliacrilonitrin được dùng để sản xuất to olon, làm sợi “len" đan áo ấm.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, cao su thiên nhiên có thành phần chính là poliisopren.
(b) Sai, xenlulozơ không tan trong nước nhưng không tan trong các dung môi hữu cơ thông thường.
(c)(d)(e) Đúng
Chọn C
Câu 28:
Cho 8,9 gam H2NCH(CH3)COOH phản ứng hoàn toàn với dung dịch KOH vừa đủ, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
H2NCH(CH3)COOH + KOH —> H2NCH(CH3)COOK + H2O
nAlaK = nAla = 0,1 —> mAlaK = 12,7 gam
Chọn C
Câu 29:
Cho 1,68 gam bột Fe tác dụng hết với dung dịch chứa 0,07 mol AgNO3, thu được m gam chất rắn và dung dịch X. Giá trị của m là
 Xem đáp án
Xem đáp án
nFe = 0,03
Dễ thấy 2nFe < nAg+ < 3nFe nên Fe tan hết, Ag+ cũng hết, chất rắn chỉ có Ag
—> mAg = 7,56 gam
Chọn A
Câu 30:
Chia 19,92 gam hỗn hợp X gồm metan, propilen, isopren thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một thì thu được 31,68 gam CO2. Phần hai trộn với 0,3 mol H2 rồi dẫn qua bột Ni đốt nóng thu được hỗn hợp Y có tỉ khối so với hiđro là 13,2. Y làm mất màu tối đa m gam Br2 trong dung dịch. Giá trị của m là
 Xem đáp án
Xem đáp án
Mỗi phần nặng 9,96 gam
X gồm CH4, C3H6, C5H8 —> Có dạng CxHx+3
nCO2 = 0,72 —> nX = 0,72/x
—> MX = 13x + 3 = 9,96x/0,72 —> x = 3,6
—> nX = 0,2
mY = mX + mH2 = 10,56 —> nY = 0,4
—> nH2 phản ứng = (nX + nH2) – nY = 0,1
Bảo toàn liên kết pi: 0,2(2x + 2 – x – 3)/2 = nH2 phản ứng + nBr2
—> nBr2 = 0,16 —> mBr2 = 25,6
Chọn B
Câu 31:
Este E là este no, mạch hở và có công thức phân tử C7HmOm-4. Cho E tác dung với dung dung dịch NaOH dư sau phản ứng hoàn toàn thu được hai muối X, Y (đều là muối của axit cacboxylic, MX < MY) và một ancol Z. Cho các phát biểu sau:
(a) Có 2 công thức cấu tạo phù hợp tính chất của E.
(b) X là muối của axit cacboxylic có khả năng tham gia phản ứng tráng bạc.
(c) Trong phân tử Z thì số nguyên tử cacbon bằng số nhóm -OH.
(d) Nung muối Y với hỗn hợp vôi tôi-xút thu được khí H2.
(e) Phân tử Y hơn phân tử X một nhóm CH2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
E là este no, mạch hở nên k = số chức este = (m – 4)/2
—> (m – 4)/2 = (7.2 + 2 – m)/2 —> m = 10
—> E là C7H10O6
Cấu tạo: (HCOO)2(CH3COO)C3H5
X là HCOONa, Y là CH3COONa, Z là C3H5(OH)3
(a) Đúng, gồm:
CH3COOCH2-CH(OOCH)-CH2(OOCH)
CH3COOCH(CH2OOCH)2
(b) Đúng, HCOOH hay HO-CHO có tráng bạc.
(c) Đúng, Z có 3C, 3OH
(d) Sai: CH3COONa + NaOH —> CH4 + Na2CO3
(e) Đúng
Chọn C
Câu 32:
Cho sơ đồ chuyển hóa sau:
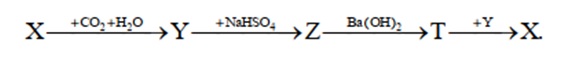
Biết X, Y, Z, T đều là hợp chất của natri. Các chất X và T tương ứng là
 Xem đáp án
Xem đáp án
X: Na2CO3
Y: NaHCO3
Z: Na2SO4
T: NaOH
Chọn B
Câu 33:
Hỗn hợp E gồm axit panmitic, axit oleic và axit stearic (tỉ lệ mol lần lượt là 3 : 2 : 1) và các triglixerit Y. Đốt cháy hoàn toàn m gam E bằng oxi, thu được H2O và 13,45 mol CO2. Mặt khác, cho m gam E tác dụng với dung dịch chứa 0,9 mol KOH (lấy dư 20%) đun nóng, thu được glixerol và hỗn hợp chứa 3 muối có số mol đều bằng nhau. Phần trăm khối lượng của axit oleic trong m gam E gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nKOH phản ứng = 0,75
—> nC15H31COOK = nC17H35COOK = nC17H33COOK = 0,25
—> nC (muối) = 13 và m muối = 234
Bảo toàn C —> nY = nC3H5(OH)3 = (13,45 – 13)/3 = 0,15
—> nH2O = nAxit béo trong E = 0,75 – 0,15.3 = 0,3
—> nC15H31COOH = 0,15; nC17H33COOH = 0,1
Bảo toàn khối lượng:
mE + mKOH phản ứng = m muối + mC3H5(OH)3 + mH2O
—> mE = 211,2
%C17H33COOH = 13,35%
Chọn B
Câu 34:
Cho các chất mạch hở: X là axit cacboxylic không no, mạch cacbon không phân nhánh và có hai liên kết π trong phân tử; Y và Z là hai axit cacboxylic no, đơn chức; T là ancol no, ba chức; E là este tạo bới T và X, Y, Z. Hỗn hợp M gồm X và E. Biết:
– Đốt cháy hoàn toàn m gam hỗn hợp M thu được a gam CO2 và (a – 4,62) gam H2O.
– Cho m gam M vào dung dịch KOH dư đun nóng nhẹ sau phản ứng hoàn toàn thấy có 0,04 mol KOH phản ứng.
– Mặt khác, cho 13,2 gam M phản ứng vừa đủ với dung dịch NaOH khi đun nóng nhẹ, thu được hỗn hợp muối khan A. Đốt cháy hết A bằng khí O2 dư thu được 0,4 mol CO2 và 14,24 gam gồm Na2CO3 và H2O.
Phần trăm khối lượng chất E trong hỗn hợp M gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
X là CxH2x-2O2 (u), E là CyH2y-6O6 (v)
nKOH = u + 3v = 0,04 (1)
nCO2 – nH2O = a/44 – (a – 4,62)/18 = u + 3v = 0,04
—> a = 6,6
—> nCO2 = 0,15 và nH2O = 0,11
mM = 0,15.12 + 0,11.2 + 0,04.32 = 3,3
Dễ thấy 13,2/3,3 = 4 lần nên chia các số liệu cho 4 để cùng lượng ban đầu: mM = 3,3; nCO2 = 0,1; mNa2CO3 + mH2O = 3,56
nNaOH = nKOH = 0,04 —> nNa2CO3 = 0,02
—> nH2O = (3,56 – mNa2CO3)/18 = 0,08
—> n muối có 2π = nCO2 – nH2O = 0,02
⇔ u + v = 0,02 (2)
(1)(2) —> u = v = 0,01
nCO2 = 0,01x + 0,01y = 0,15 —> x + y = 15
y = x + C (ancol) + C (2 axit no) nên y > x + 6
Mặt khác x ≥ 3; y ≥ 8 nên có các nghiệm:
x = 3, y = 12 —> C3H4O2 (0,01) và C12H18O6 (0,01) —> %E = 78,18%
x = 4, y = 11 —> C4H6O2 (0,01) và C11H16O6 (0,01) —> %E = 73,94%
Chọn B
Câu 35:
Cho các phát biểu sau:
(1) Tinh bột là một trong những lương thực cơ bản của con người.
(2) Phân tử amilozơ và amilopectin đều có cấu trúc mạch phân nhánh.
(3) Ở nhiệt độ thường, tripanmitin và tristearin đều ở trạng thái rắn.
(4) Glucozơ và fructozơ đều có trong mật ong nên độ ngọt của chúng là như nhau.
(5) Các amino axit khi nóng chảy tạo thành dung dịch nhớt, để nguội sẽ rắn lại.
(6) Saccarozơ chỉ tồn tại dưới dạng mạch vòng.
(7) Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ thành phân tử lớn đồng thời giải phóng những phân tử nhỏ khác như H2O.
(8) Các monome tham gia phản ứng trùng ngưng phải có ít nhất hai nhóm chức có khả năng phản ứng để tạo được liên kết với nhau.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1) Đúng
(2) Sai, amilozơ mạch thẳng.
(3) Đúng, các chất béo này đều no nên ở dạng rắn
(4) Sai, fructozơ độ ngọt cao hơn glucozơ.
(5) Sai, amino axit nóng chảy và bị phân hủy một phần. Nóng chảy tạo chất lỏng nhớt là tính chất của polime.
(6) Đúng
(7) Đúng
(8) Đúng
Chọn C
Câu 36:
Thực hiện các thí nghiệm sau:
(a) Cho Fe vào dung dịch AgNO3 dư.
(b) Cho Na vào dung dịch CuSO4 dư.
(c) Cho dung dịch NaOH dư vào dung dịch Ba(HCO3)2.
(d) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2 dư.
(e) Cho Mg dư vào dung dịch FeCl3.
Có bao nhiêu thí nghiệm thu được dung dịch chứa 2 muối?
 Xem đáp án
Xem đáp án
(a) Fe + AgNO3 dư —> Fe(NO3)3 + Ag
Dung dịch sau phản ứng chứa Fe(NO3)3, AgNO3 dư
(b) Na + H2O —> NaOH + H2
NaOH + CuSO4 —> Cu(OH)2 + Na2SO4
Dung dịch sau phản ứng chứa Na2SO4, CuSO4 dư
(c) NaOH dư + Ba(HCO3)2 —> BaCO3 + Na2CO3 + H2O
Dung dịch sau phản ứng chứa Na2CO3, NaOH dư
(d) KHSO4 + Ba(HCO3)2 —> BaSO4 + KHCO3 + CO2 + H2O
Dung dịch sau phản ứng chứa KHCO3, Ba(HCO3)2 dư
(e) Mg dư + FeCl3 —> MgCl2 + Fe
Dung dịch sau phản ứng chứa MgCl2.
Chọn A
Câu 37:
Dẫn 0,075 mol hỗn hợp X gồm hơi nước và khí CO2 đi qua than nung đỏ thu được x mol hỗn hợp Y gồm CO, CO2 và H2. Dẫn Y đi qua ống sứ đựng 18,0 gam hỗn hợp gồm CuO, Fe2O3 (dư) nung nóng thu được 16,4 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Giá trị của x là
 Xem đáp án
Xem đáp án
nO = (18 – 16,4)/16 = 0,1
Bảo toàn electron: 4nC = 2nO —> nC = 0,05
nC = nY – nX —> nY = 0,125
Chọn A
Câu 38:
Hòa tan hết 35,84 gam hỗn hợp X gồm FeCl3, Mg, Fe(NO3)2 và Fe(NO3)3 vào dung dịch chứa 0,96 mol HCl thu được dung dịch Y và 2,688 lít khí NO (đo ở đktc). Cho từ từ dung dịch AgNO3 dư vào Y đến khi các phản ứng hoàn toàn thì thấy lượng AgNO3 phản ứng là 214,2 gam, kết thúc phản ứng thu được 178,68 gam kết tủa; 0,448 lít khí NO (sản phẩm khử duy nhất của N+5, đo ở đktc). Phần trăm khối lượng của Mg đơn chất trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Y + AgNO3 —> nNO = 0,02 nên Y không còn NO3- và Y chứa nH+ dư = 4nNO = 0,08
X + HCl —> nNO = 0,12
nH+ phản ứng = 0,96 – 0,08 = 4nNO + 10nNH4+
—> nNH4+ = 0,04
Bảo toàn N —> nNO3-(X) = 0,12 + 0,04 = 0,16
Kết tủa gồm AgCl (u) và Ag (v)
nAgNO3 = u + v = 1,26
m↓ = 143,5u + 108v = 178,68
—> u = 1,2 và v = 0,06
Bảo toàn Cl —> nCl-(X) = 1,2 – 0,96 = 0,24
Quy đổi X thành Fe (a), Mg (b), Cl (0,24) và NO3 (0,16)
mX = 56a + 24b + 0,24.35,5 + 0,16.62 = 35,84
Bảo toàn electron:
3a + 2b = 3nNO tổng + 8nNH4+ + nAg + nCl + nNO3
—> a = 0,15 và b = 0,375
—> %Mg = 25,11%
Chọn B
Câu 39:
Thí nghiệm điều chế và thử tính chất của khí X được tiến hành theo các bước sau:
• Bước 1: Cho 2 ml ancol etylic khan vào ống nghiệm khô đã có sẵn vài viên đá bọt (ống số 1) rồi thêm từ từ 4 ml dung dịch H2SO4 đặc và lắc đều. Nút ống số 1 bằng nút cao su có ống dẫn khí rồi lắp lên giá thí nghiệm.
• Bước 2: Lắp lên giá thí nghiệm khác một ống hình trụ được đặt nằm ngang (ống số 2) rồi nhồi một nhúm bông tẩm dung dịch NaOH đặc vào phần giữa ống. Cắm ống dẫn khí của ống số 1 xuyên qua nút cao su rồi nút vào một đầu của ống số 2. Nút đầu còn lại của ống số 2 bằng nút cao su có ống dẫn khí. Nhúng ống dẫn khí của ống số 2 vào dung dịch KMnO4 đựng trong ống nghiệm (ống số 3).
• Bước 3: Dùng đèn cồn đun nóng hỗn hợp trong ống số 1.
Cho các phát biểu sau:
(a) Khí X là axetilen.
(b) Bông tẩm dung dịch NaOH đặc có tác dụng ngăn không cho X thoát ra môi trường.
(c) Đá bọt có vai trò làm cho chất lỏng không trào lên khi đun nóng.
(d) Trong thí nghiệm trên, ở ống số 3 có chất rắn màu nâu đen.
(e) Khí X có tác dụng kích thích quả chín.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, X là C2H4 (etilen): C2H5OH (H2SO4 đặc, t°) → C2H4 + H2O
(b) Sai, bông tẩm NaOH để giữ lại sản phẩm phụ như CO2, SO2 sinh ra do H2SO4 đặc oxi hóa C2H5OH.
(c) Đúng
(d) Đúng: C2H4 + H2O + KMnO4 → KOH + MnO2↓ + C2H4(OH)2.
(e) Đúng, các khí như etilen, axetilen đều kích thích quả mau chín.
Chọn D
Câu 40:
Điện phân dung dịch chứa Cu(NO3)2, CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 2895 |
2t |
|
Lượng khi sinh ra ở hai điện cực (mol) |
a |
a + 0,03 |
2,125a |
|
Số mol Cu ở catot |
b |
b + 0,02 |
b + 0,02 |
Giá trị của a là:
 Xem đáp án
Xem đáp án
Trong khoảng thời gian 2895 (s) (trao đổi 0,06 mol electron) thì tại cực âm thoát ra 0,02 mol Cu và 0,01 mol H2
—> 0,02 mol khí còn lại gồm Cl2 (x mol) và O2 (y mol)
—> x + y = 0,02 và 2x + 4y = 0,06
—> x = y = 0,01
Trong khoảng thời gian từ t + 2895 —> 2t chỉ là điện phân H2O nên phần khí tăng thêm là 2,125a – a – 0,03 = 1,125a – 0,03 chỉ bao gồm O2 và H2. Do nH2 = 2nO2 nên:
nO2 = 0,375a – 0,01
nH2 = 0,75a – 0,02
Như vậy trong thời gian từ t —> 2t thì tại cực dương có:
nCl2 = 0,01
nO2 = 0,375a – 0,01 + y = 0,375a
Bảo toàn electron cho cực dương ở 2 khoảng thời gian (0 —> t) và (t —> 2t)
2a = 0,01.2 + 0,375a.4 —> a = 0,04
Chọn B
