(2023) Đề thi thử Hóa Sở giáo dục đào tạo Thanh Hóa (Lần 2) có đáp án
(2023) Đề thi thử Hóa Sở giáo dục đào tạo Thanh Hóa (Lần 2) có đáp án
-
1001 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Dung dịch NaOH phản ứng được với chất nào sau đây?
 Xem đáp án
Xem đáp án
Dung dịch NaOH phản ứng được với Al2O3:
Al2O3 + NaOH → NaAlO2 + H2O
Câu 2:
Cho thanh kim loại Zn vào dung dịch chất nào sau đây có xảy ra hiện tượng ăn mòn điện hoá học?
 Xem đáp án
Xem đáp án
Cho thanh kim loại Zn vào dung dịch CuSO4 có xảy ra hiện tượng ăn mòn điện hoá học vì:
Zn + CuSO4 → ZnSO4 + Cu
Cu sinh ra bám vào Zn tạo cặp điện cực Zn-Cu tiếp xúc với nhau và cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hóa.
Câu 4:
Giấm ăn là dung dịch có chứa axit axetic nồng độ 2%-5%. Công thức của axit axetic là
 Xem đáp án
Xem đáp án
Chọn A
Câu 5:
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Trong công nghiệp, kim loại Na được điều chế bằng phương pháp điện phân nóng chảy muối NaCl:
2NaCl điện phân nóng chảy → 2Na + Cl2
Câu 9:
Sắt tác dụng với lượng dư dung dịch chất nào sau đây thu được hợp chất sắt(III)?
 Xem đáp án
Xem đáp án
A. Không phản ứng
B. HCl dư + Fe → FeCl2 + H2
C. CuSO4 dư + Fe → FeSO4 + Cu
D. AgNO3 dư + Fe → Fe(NO3)3 + Ag
Câu 12:
Chất nào sau đây là amin bậc hai?
 Xem đáp án
Xem đáp án
Khi thay thế 2H trong NH3 bằng 2 gốc hiđrocacbon ta được amin bậc II.
→ CH3NHCH3 là amin bậc II.
Câu 13:
Chất có khả năng làm mềm nước có tính cứng toàn phần là
 Xem đáp án
Xem đáp án
K3PO4 được dùng để làm mềm nước có tính cứng toàn phần vì:
Ca2+ + PO43- → Ca3(PO4)2↓
Mg2+ + PO43- → Mg3(PO4)2↓
Câu 16:
Kim loại nào sau đây khử được Cu2+ trong dung dịch thành Cu?
 Xem đáp án
Xem đáp án
Kim loại Mg khử được Cu2+ trong dung dịch thành Cu:
Mg + Cu2+ → Mg2+ + Cu
Na, K khử H2O trước; Ag không khử được Cu2+.
Câu 19:
Khí sunfurơ có mùi hắc, rất độc là tác nhân chủ yếu gây mưa axit. Công thức của khí sunfurơ là
 Xem đáp án
Xem đáp án
Chọn D
Câu 21:
Chất X là một cacbohiđrat tạo nên màng tế bào thực vật. Thủy phân hoàn toàn X trong môi trường axit ở nhiệt độ cao thu được chất Y. Khử chất Y bằng H2 (xúc tác Ni, đun nóng) thu được chất hữu cơ Z. Tên gọi của X và Z lần lượt là
 Xem đáp án
Xem đáp án
X là một cacbohidrat tạo nên màng tế bào thực vật → X là xenlulozơ
→ Y là glucozơ và Z là sobitol.
Câu 22:
Cho 29,8 gam hỗn hợp bột gồm Zn và Fe vào 600 ml dung dịch CuSO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và 30,4 gam hỗn hợp kim loại. Phần trăm về khối lượng của Fe trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
nCuSO4 = 0,3
Nếu chỉ có Zn phản ứng thì:
nZn = (30,4 – 29,8)/(65 – 64) ≠ 0,3: Vô lý, loại
Vậy Zn phản ứng hết, Fe phản ứng một phần.
mFe dư = 30,4 – 0,3.64 = 11,2
Đặt a, b là số mol Zn và Fe phản ứng
→ 65a + 56b + 11,2 = 29,8
nCuSO4 = a + b = 0,3
→ a = 0,2; b = 0,1
→ %Fe = (0,1.56 + 11,2)/29,8 = 56,37%
Câu 23:
Cho lượng dư Fe lần lượt tác dụng với các dung dịch: CuSO4, MgCl2, HNO3, H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, số trường hợp sinh ra muối sắt (II) là
 Xem đáp án
Xem đáp án
Có 3 trường hợp sinh ra muối sắt (II) là:
CuSO4 + Fe dư → FeSO4 + Cu
HNO3 + Fe dư → Fe(NO3)2 + NO + H2O
H2SO4 loãng + Fe dư → FeSO4 + H2
Câu 24:
Khử hoàn toàn một lượng Fe3O4 bằng H2 dư, thu được chất rắn X và m gam H2O. Hòa tan hết X trong dung dịch HCl dư, thu được 1,008 lít khí H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
nFe = nH2 = 0,045
Bảo toàn Fe → nFe3O4 = 0,015
Bảo toàn O → nH2O = nO = 0,06
→ mH2O = 1,08
Câu 25:
Lên men m gam glucozơ để tạo thành ancol etylic (hiệu suất phản ứng bằng 90%). Hấp thụ hoàn toàn lượng khí CO2 sinh ra vào dung dịch Ca(OH)2 dư, thu được 15 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
nCO2 = nCaCO3 = 0,15
→ nC6H12O6 phản ứng = 0,075
→ mC6H12O6 đã dùng = 0,075.180/90% = 15 gam
Câu 26:
Đốt cháy hoàn toàn 0,15 mol một amin X no, đơn chức, mạch hở bằng khí oxi vừa đủ thu được 1,2 mol hỗn hợp gồm CO2, H2O và N2. Số amin bậc một phù hợp với X là
 Xem đáp án
Xem đáp án
X dạng CxH2x+3N
→ nCO2 + nH2O + nN2 = 0,15(x + x + 1,5 + 0,5) = 1,2
→ x = 3
X là C3H9N, có 2 đồng phân bậc 1:
CH3-CH2-CH2-NH2
CH3-CH(NH2)-CH3
Câu 27:
Thủy phân este X có công thức C4H8O2 thu được ancol metylic. Tên gọi của X là
 Xem đáp án
Xem đáp án
X là C2H5COOCH3 (metyl propionat):
C2H5COOCH3 + NaOH → C2H5COONa + CH3OH
Câu 28:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Sai, thạch cao nung có công thức CaSO4.H2O.
B. Đúng, thép chứa Fe và C tạo cặp điện cực Fe-C tiếp xúc với nhau và cùng tiếp xúc với môi trường điện li nên có xảy ra ăn mòn điện hoá học.
C. Đúng
D. Đúng, dầu hỏa không tác dụng với Na, không hút ẩm, không hòa tan O2 nên ngăn Na tiếp xúc với môi trường bên ngoài.
Câu 29:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, tơ nilon-6,6 được điều chế bằng phản ứng trùng ngưng HOOC-(CH2)4-COOH và H2N-(CH2)6-NH2.
B. Đúng
C. Sai, tơ nitron được điều chế bằng phản ứng trùng hợp CH2=CH-CN.
D. Sai, cao su lưu hóa có cấu trúc mạch không gian.
Câu 30:
Khi thủy phân hết 3,98 gam hỗn hợp X gồm hai este đơn chức, mạch hở thì cần vừa đủ 0,05 mol NaOH, thu được một ancol và hỗn hợp Y gồm hai muối của hai axit cacboxylic cùng dãy đồng đẳng. Mặt khác, đốt cháy hết 3,98 gam X trong O2 dư, thu được CO2 và m gam H2O. Giá trị của m là
 Xem đáp án
Xem đáp án
X đơn chức, mạch hở nên nX = nNaOH = 0,05
→ MX = 79,6
Mặt khác từ X tạo 1 ancol nên X no, có dạng CxH2xO2
MX = 14x + 32 = 79,6 → x = 3,4
nH2O = 0,05x = 0,17 → mH2O = 3,06 gam
Câu 31:
Sản xuất phân supephotphat kép thường sử dụng quặng photphorit (có thành phần chính là Ca3(PO4)2) và dung dịch H2SO4 70% theo các giai đoạn sau:
• Giai đoạn 1: Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4.
• Giai đoạn 2: Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2.
Phân lân thu được có độ dinh dưỡng 56,8%, thành phần gồm Ca(H2PO4)2 và các chất khác không chứa photpho. Để sản xuất được một tấn phân lân theo hai giai đoạn trên cần dùng tối thiểu m tấn dung dịch H2SO4 70%. Biết hiệu suất phản ứng của giai đoạn 1 là 80%, giai đoạn 2 là 70%. Giá trị của m là
 Xem đáp án
Xem đáp án
Phản ứng gộp:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
nCa(H2PO4)2 = nP2O5 = 1000.56,8%/142 = 4 kmol
→ nH2SO4 phản ứng = 8 kmol
→ mdd H2SO4 cần dùng = 8.98/70%.80%.70% = 2000 kg = 2 tấn
Câu 32:
Bình “gas” sử dụng trong hộ gia đình Y có chứa khí hóa lỏng (LPG) gồm propan và butan với tỉ lệ mol tương ứng là 3 : 4. Khi được đốt cháy hoàn toàn một mol propan tỏa ra lượng nhiệt là 2220 kJ và một mol butan tỏa ra lượng nhiệt là 2850 kJ. Để đun một lít nước (D = 1,00 g/ml) từ 25°C lên 100°C cần m gam gas, biết rằng muốn nâng một gam nước lên 1,0°C cần tiêu tốn hết 4,18 J (giả thiết chỉ có 80% lượng nhiệt đốt cháy từ khí gas dùng để tăng nhiệt của nước). Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nC3H8 = 3x; nC4H10 = 4x, bảo toàn năng lượng:
80%(2220.3x + 2850.4x).10³ = 1000.1.4,18(100 – 25)
→ x = 0,0217
→ mGas = 44.3x + 58.4x = 7,9 gam
Câu 33:
Cho các phát biểu sau:
(a) Tơ nitron được điều chế bằng phản ứng trùng ngưng.
(b) Peptit Gly-Ala tham gia phản ứng màu biure.
(c) Ở điều kiện thường, alanin là chất lỏng.
(d) Ở điều kiện thích hợp, tripanmitin tham gia phản ứng cộng H2.
(e) Saccarozơ bị hóa đen khi tiếp xúc với H2SO4 đặc.
(g) Ở điều kiện thường, glucozơ và saccarozơ đều là những chất rắn, dễ tan trong nước.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, tơ nitron điều chế bằng phản ứng trùng hợp CH2=CH-CN
(b) Sai, đipeptit không tham gia phản ứng màu biure.
(c) Sai, alanin tồn tại ở dạng ion lưỡng cực nên có dạng tinh thể (thể rắn) điều kiện thường
(d) Sai, tripanmitin là chất béo no
(e) Đúng, H2SO4 đặc háo nước mạnh làm saccarozơ bị mất nước hóa thành than (đen).
(g) Đúng
Câu 34:
Đốt cháy hoàn toàn m gam hỗn hợp X gồm triglixerit Y và axit béo Z cần vừa đủ 1,855 mol O2, thu được 1,32 mol CO2 và 1,21 mol H2O. Cho m gam X tác dụng với 80 ml dung dịch NaOH 1M, sau khi các phản ứng xảy ra hoàn toàn, thu được glixerol và dung dịch T. Cô cạn T, thu được 21,68 gam rắn chứa hai chất. Phần trăm khối lượng của Z trong X là
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng → mX = 20,5
Đặt nY = y và nZ = z, bảo toàn O:
6y + 2z + 1,855.2 = 1,32.2 + 1,21
Bảo toàn khối lượng:
20,5 + 0,08.40 = 21,68 + 92y + 18z
→ y = 0,02; z = 0,01
nNaOH phản ứng = 3y + z = 0,07
→ Chất rắn gồm RCOONa (0,07) và NaOH dư (0,01)
m rắn = 0,07(R + 67) + 0,01.40 = 21,68
→ R = 237
%Z = 0,01(R + 45)/20,5 = 13,76%
Câu 35:
Cho các phát biểu sau:
(a) Cho dung dịch NH3 vào dung dịch AlCl3 có xuất hiện kết tủa.
(b) Nhiệt phân hoàn toàn Cu(NO3)2 tạo thành Cu.
(c) Hỗn hợp Na2O và Al (tỉ lệ mol 1:1) tan hết trong nước dư.
(d) Trong công nghiệp dược phẩm, NaHCO3 được dùng để điều chế thuốc đau dạ dày.
(e) Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy AlCl3.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng.
3NH3 + 3H2O + AlCl3 → Al(OH)3 + 3NH4Cl
(b) Sai: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
(c) Đúng:
Na2O + H2O → 2NaOH
Al + NaOH + H2O → NaAlO2 + 1,5H2
(d) Đúng
(e) Sai, điện phân nóng chảy Al2O3.
Câu 36:
Hỗn hợp M gồm 2 este X, Y mạch hở đều tạo bởi axit cacboxylic và ancol, MX < MY < 250. Đốt cháy hoàn toàn 7,05 gam M thu được 0,24 mol CO2 và 0,165 mol H2O. Mặt khác, thủy phân hoàn toàn 7,05 gam M bằng NaOH vừa đủ thu được một ancol Z và hỗn hợp muối T. Đốt cháy hoàn toàn T thu được Na2CO3, H2O và 0,06 mol CO2. Phần trăm khối lượng của X trong M là
 Xem đáp án
Xem đáp án
nO(M) = (mM – mC – mH)/16 = 0,24 → nNaOH = 0,12
→ nNa2CO3 = 0,06
→ nC(muối) = nCO2 + nNa2CO3 = 0,12
Muối có nNa = nC → Muối gồm HCOONa và (COONa)2
Este có nC = nO và MX < MY < 250 nên X, Y là 2 trong số các este C2H4O2, C4H6O4, C6H8O6, C8H10O8. Giá trị H/C tương ứng là 2 – 1,5 – 1,33 – 1,25
Theo đề thì nH/nC = 0,165.2/0,24 = 1,375
Xà phòng hóa chỉ tạo 1 ancol Z nên nếu X là C2H4O2 (HCOOCH3) thì Y là (COOCH3)2 → Loại vì không thỏa mãn nH/nC ở trên.
Vậy X là C4H6O4, cấu tạo (HCOO)2C2H4 (0,03)
Y là HCOO-CH2-CH2-OOC-COO-CH2-CH2-OOCH (0,015)
→ %X = 50,21%
Câu 37:
Cho sơ đồ chuyển hóa:
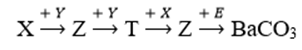
Chất X còn được gọi là xút ăn da; Y, Z, T là các hợp chất khác nhau; mỗi mũi tên ứng với một phương trình hóa học. Các chất T và E thỏa mãn sơ đồ trên là
 Xem đáp án
Xem đáp án
X còn được gọi là xút ăn da → X là NaOH
→ Y là CO2, Z là Na2CO3, T là NaHCO3, E là Ba(OH)2.
(Loại E là Ba3(PO4)2 vì muối này không tan, không phản ứng với Na2CO3).
NaOH + CO2 → Na2CO3 + H2O
CO2 + H2O + Na2CO3 → NaHCO3
NaHCO3 + NaOH → Na2CO3 + H2O
Na2CO3 + Ba(OH)2 → BaCO3 + NaOH
Câu 38:
Dung dịch X chứa m gam hỗn hợp Cu(NO3)2 và NaCl. Tiến hành điện phân X với điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hoà tan các khí trong nước và sự bay hơi của nước, cường độ dòng điện không đổi 5A. Nếu thời gian điện phân là t giây thì thu được hỗn hợp khí có tỉ khối so với H2 bằng 25,75, dung dịch Y (vẫn còn màu xanh) và 7,68 gam kim loại ở catot. Nếu thời gian điện phân là 6176 giây thì thu được dung dịch Z và 2,464 lít khí (đktc) thoát ra ở hai điện cực. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Sau t giây dung dịch Y còn màu xanh nên Cu2+ chưa hết.
Catot: nCu = 0,12
Anot: nCl2 = u và nO2 = v
Bảo toàn electron → 2u + 4v = 0,12.2
m khí = 71u + 32v = 25,75.2(u + v)
→ u = v = 0,04
Khi thời gian là 6176 giây thì ne = It/F = 0,32
Catot: nCu = a và nH2 = b
Anot: nCl2 = 0,04 và nO2 = c
Bảo toàn electron: 2a + 2b = 0,04.2 + 4c = 0,32
n khí = b + c + 0,04 = 0,11
→ a = 0,15; b = 0,01; c = 0,06
A. Đúng
B. Sai, mCu(NO3)2 = 188a = 28,2 gam
C. Sai, trong Y có a – 0,12 = 0,03 mol Cu2+
D. Sai, Z chứa Na+ (2u = 0,08), nNO3- (2a = 0,3), bảo toàn điện tích → nH+ = 0,22
→ Trung hòa Z cần 0,22 mol NaOH.
Câu 39:
Nung nóng m gam hỗn hợp gồm Al và hai oxit sắt trong khí trơ, thu được hỗn hợp rắn X. Nghiền nhỏ X, trộn đều rồi chia thành hai phần. Phần một phản ứng được tối đa với dung dịch chứa 0,07 mol NaOH, thu được 0,015 mol H2. Phần hai tan hết trong dung dịch chứa 1,03 mol H2SO4 đặc nóng, thu được dung dịch Y chỉ chứa các muối trung hòa và 0,335 mol SO2 (sản phẩm khử duy nhất của H2SO4). Dung dịch Y tác dụng vừa đủ với 0,01 mol KMnO4 trong dung dịch H2SO4 loãng dư. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Phần 1:
nNaOH = 0,07 → nAl ban đầu = 0,07
nH2 = 0,015 → nAl dư = 0,01
→ nAl phản ứng = 0,06 → nO = 0,09
Phần 2:
nH2SO4 = 2nSO2 + nO → nO = 0,36
Dễ thấy 0,36/0,09 = 4 lần nên phần 2 gấp 4 lần phần 1.
Phần 2 gồm Al (0,07.4 = 0,28), O (0,36) và Fe. Bảo toàn electron:
3nAl + 3nFe = 2nO + 2nSO2 + 5nKMnO4
→ nFe = 0,2
→ m phần 2 = 24,52
→ m = 24,52 + 24,52/4 = 30,65
(Chú ý: Đề độ chế nên sai, không có 2 oxit nào thỏa mãn nFe = 0,2 và nO = 0,36, oxi quá nhiều)
Câu 40:
Cho E, Z, F, T đều là các hợp chất hữu cơ no, mạch hở, chỉ chứa một loại nhóm chức trong phân tử và thỏa mãn các sơ đồ phản ứng theo đúng tỉ lệ mol:
(1) E + NaOH (t°) → X + Z
(2) F + NaOH (t°) → X + Y
(3) X + HCl → T + NaCl
Biết E là este đơn chức và trong phân tử E, F có số nguyên tử cacbon bằng số nguyên tử oxi; ME < MF < 140. Cho các phát biểu sau:
(a) Có hai công thức cấu tạo của F thỏa mãn sơ đồ trên.
(b) Chất Y có khả năng hoà tan Cu(OH)2.
(c) Đun Z với H2SO4 đặc ở 180°C thu được etilen.
(d) Chất X có khả năng tham gia phản ứng tráng bạc.
(e) Dung dịch 3% chất T được dùng làm giấm ăn.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
E đơn chức, có số C = số O → E là C2H4O2, cấu tạo HCOOCH3.
→ X là HCOONa, Z là CH3OH, T là HCOOH
nF : nNaOH = 1 : 1 nên F chỉ có 1 chức este
MF < 140 và F có số C = số O nên F có các cấu tạo:
HCOO-CH2-CH2OH
HCOO-CH2-CHOH-CH2OH
HCOO-CH(CH2OH)2
→ Y là C2H4(OH)2 hoặc C3H5(OH)3
(a) Sai, F có 3 cấu tạo thỏa mãn.
(b) Đúng
(c) Sai, CH3OH có 1C nên không tạo được C2H4.
(d) Đúng
(e) Sai, giấm ăn là dung dịch CH3COOH 2-5%.
