(2023) Đề thi thử Hóa Học THPT soạn theo ma trận đề minh họa BGD ( Đề 6) có đáp án
(2023) Đề thi thử Hóa Học THPT soạn theo ma trận đề minh họa BGD ( Đề 6) có đáp án
-
746 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 4:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 5:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 6:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 9:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 12:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 13:
Freon-12 là một loại chất CFC có công thức CCl2F2 được sử dụng khá phổ biến để làm lạnh, bị hạn chế sử dụng là do chất này khi lọt ra khí quyển
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 14:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 16:
Cho vào ống nghiệm một viên kẽm, sau đó cho tiếp 1 – 2 ml dung dịch chất X đậm đặc vào ống nghiệm. Sau một thời gian thấy bọt khí thoát ra, viên kẽm tan dần. Chất X là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 21:
Hòa tan hết 8,08 gam hỗn hợp gồm MgO và ZnO cần vừa đủ 240 ml dung dịch HCl 1M, sau phản ứng thu được dung dịch chứa m gam hỗn hợp muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 23:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 24:
Lên men m gam tinh bột, thu được 100 ml dung dịch C2H5OH 460. Biết hiệu suất của cả quá trình là 60% và khối lượng riêng của C2H5OH bằng 0,8 gam/ml. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 25:
Cho 15 gam hỗn hợp các amin gồm anilin, metylamin, đimetylamin, đietylmetylamin tác dụng vừa đủ với 50 ml dung dịch HCl 1M. Khối lượng sản phẩm thu được có giá trị là :
 Xem đáp án
Xem đáp án
Đáp án A
Áp dụng BTKL ta có: ® = 15 + 0,05 . 36,5 = 16,825
Câu 26:
Cacbohidrat X có đặc điểm:
Bị thủy phân trong môi trường axit
Thuộc loại polisaccarit
Phân tử gồm nhiều gốc β-glucozơ
Cacbohidrat X là ?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 27:
Hòa tan hoàn tan 41,2 gam hỗn hợp X chứa Cu và trong dung dịch chứa HCl thu được dung dịch Y chỉ chứa hỗn hợp các muối. Mặt khác cũng hòa tan hoàn toàn lượng X trên bằng dung dịch chứa loãng thì thu được dung dịch Z cũng chỉ chứa hỗn hợp các muối trung hòa. Cô cạn Y và Z thì thấy lượng muối trong Z nhiều hơn trong Y là 15 gam. Phần trăm khối lượng Cu trong Xgần nhấtvới:
 Xem đáp án
Xem đáp án
Đáp án A
Ta có:
Câu 28:
Este X mạch hở có công thức phân tử C4H6O2. Đun nóng a mol X trong dung dịch NaOH vừa đủ thu được dung dịch Y. Cho toàn bộ Y tác dụng với lượng dư dung dịch AgNO3/NH3 thu được 4a mol Ag. Biết các phản ứng xảy ra hoàn toàn. Công thức cấu tạo của X là :
 Xem đáp án
Xem đáp án
Đáp án A
Y có phản ứng tráng gương => este X có dạng HCOOR hoặc RCOOCH = CH – R’
có 2 nhóm -CHO trong phân tử
X có dạngCâu 29:
Xà phòng hóa hoàn toàn 22,2 gam hỗn hợp gồm hai este HCOOC2H5 và CH3COOCH3 bằng dung dịch NaOH 1M ( đun nóng). Thể tích dung dịch NaOH tối thiểu cần dùng là
 Xem đáp án
Xem đáp án
Đáp án A
Hai este có chung CTPT là
Câu 30:
Thực hiện các thí nghiệm sau:
(a) Đốt dây sắt trong khí clo.
(b) Đốt nóng hỗn hợp Fe và S (trong điều kiện không có oxi).
(c) Cho FeO vào dung dịch HNO3 (loãng, dư).
(d) Cho Fe vào dung dịch H2SO4 (loãng, dư).
Có bao nhiêu thí nghiệm tạo ra muối sắt (II)?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 31:
Cho các phát biểu sau:
(a) Ở điều kiện thường, các hợp chất thuộc loại monosaccarit và đisaccarit đều tác dụng với Cu(OH)2 tạo dung dịch xanh lam.
(b) Amoniac, metylamin, trimetylamin khi tiếp xúc trực tiếp với khí hiđroclorua sẽ tạo hiện tượng khói trắng.
(c) Cao su lưu hóa có tính đàn hồi, chịu nhiệt, lâu mòn, khó tan trong các dung môi hơn cao su thường.
(d) Phản ứng giữa anilin và Br2 thể hiện sự ảnh hưởng của vòng benzen lên nhóm -NH2.
(e) Khi hàm lượng etanol trong máu (khoảng 0,3-0,4%) sẽ có hiện tượng nôn và mất tỉnh táo.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
(a) Đúng do tính chất của ancol đa chức, do các monosaccrit có nhiều nhóm -OH liền kề
(b) Đúng do xảy ra phản ứng
(c) Đúng, đây là đặc điểm của cao su lưu hóa
(d) Sai do ảnh hưởng của nhóm -NH2 lên nhân thơm
(e) Đúng do hiện tượng ngộ độc rượu
Câu 32:
Cho các phát biểu sau:
(a) Các kim loại có tính dẫn điện tốt thì thường cũng có tính dẫn nhiệt tốt.
(b) Trong không khí ẩm, gang (hợp kim của sắt và cacbon) bị ăn mòn điện hoá và tại catot cacbon bị khử.
(c) Thổi CO2 dư vào dung dịch NaAlO2 thu được kết tủa.
(d) NaOH là chất rắn, không màu, tan nhiều trong nước và toả ra một lượng nhiệt rất lớn.
(e) Phương pháp trao đổi ion chỉ có thể làm giảm độ cứng của nước cứng tạm thời.
(g) Al2O3 dùng trong công nghiệp sản xuất chất xúc tác cho tổng hợp vô cơ.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án D
(a) Đúng: Tính chất vật lí của kim loại
(b) Sai: Tại catot có các ion kim loại
(c) Đúng: Do dung dịch axit yếu không hòa tan được Al(OH)3 kết tủa
(d) Đúng: Tính chất vật lí của NaOH
(e) Sai
(g) Sai
Câu 33:
Đại dịch Covid-19 đang diễn biến phức tạp trên thế giới và ở Việt Nam. Một trong các biện pháp phòng dịch là sử dụng dung dịch cloramin B để khử khuẩn. Cloramin B có chứa 30% Clo hoạt tính về khối lượng. Hãy tính khối lượng cloramin B cần dùng để pha vào 8 lít nước thành dung dịch thuốc khử khuẩn có chứa 0,5% Clo hoạt tính về khối lượng. Biết khối lượng riêng của nước là 1g/ml.
 Xem đáp án
Xem đáp án
Đáp án A
Gọi khối lượng của Cloramin B là m gam ®
Câu 34:
Hỗn hợp E gồm triglixerit X và các axit béo. Cho 14,50 gam E tác dụng với H2 dư (Ni, t0) thu được 14,58 gam hỗn hợp Y. Mặt khác, 14,50 gam E phản ứng tối đa với 0,05 mol NaOH thu được 15,22 gam hỗn hợp muối và glyxerol. Để đốt cháy hết 14,50 gam E cần vừa đủ a lít O2 thu được CO2 và H2O. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 35:
Phản ứng tổng hợp glucozơ của cây xanh có phương trình hoá học:
Giả sử trong một phút, mỗi cm2 lá xanh hấp thụ 0,6 cal của năng lượng mặt trời và chỉ có 15% được dùng vào việc tổng hợp glucozơ. Nếu một cây có 30 lá xanh, với diện tích trung bình mỗi lá là 12 cm2. Hãy tính thời gian cần thiết để cây đó tổng hợp được 0,18 gam glucozơ (lấy giá trị gần nhất).
 Xem đáp án
Xem đáp án
Đáp án A
Năng lượng cần thiết để cây xanh tổng hợp được 0,18 gam glucozơ là:
Trong một phút, năng lượng cây hấp thụ được để tổng hợp glucozơ là:
Vậy thời gian cần thiết là : phút
Câu 36:
Hòa tan hoàn toàn 23,76g hỗn hợp gồm Cu, FeCl2 và Fe(NO3)2 vào 400 ml dung dịch HCl 1M thu được dung dịch X. Cho lượng dư dung dịch AgNO3 vào X thấy lượng AgNO3 phản ứng là 98,6g , thu được m gam kết tủa và thoát ta 0,448 lít khí (dktc). Các phản ứng xảy ra hoàn toàn và NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với :
 Xem đáp án
Xem đáp án
Đáp án A
Trong X đặt a, b, c lần lượt là số mol của FeCl2 ; Cu ; Fe(NO3)2
Khi cho AgNO3 vào Y thì có NO thoát ra
Y có H+ dư và NO3- hết, khi đó
Phần Ag+ phản ứng với
Bảo toàn e :
Câu 37:
Hợp chất hữu cơ X (được tạo thành từ các nguyên tố C, H, O) chỉ chứa một loại nhóm chức. Đun nóng 0,26 mol X với lượng vừa đủ dung dịch MOH 20% (M là kim loại kiềm). Sau khi kết thúc phản ứng, cô cạn dung dịch thu được 80,6 gam hỗn hợp chất rắn khan gồm 2 chất Y, Z và 129,48 gam nước. Trong 2 chất Y, Z thì chỉ có chất Y tác dụng được với Na. Đốt cháy hoàn toàn lượng Y ở trên cần dùng vừa đủ 46,592 lít khí O2 (ở đktc), sau phản ứng thu được 37,856 lít khí CO2 (ở đktc), 16,38 gam nước và 13,78 gam M2CO3. Nếu cho toàn bộ lượng Z ở trên tác dụng vừa đủ với dung dịch chứa 0,52 mol HCl thì thu được một axit cacboxylic Z1. Đốt cháy hoàn toàn Z1 thu được sản phẩm cháy chỉ gồm H2O và CO2 có tỉ lệ số mol là 1:1. Xác định công thức phân tử của X. Biết rằng khi cho dung dịch Y phản ứng với CO2 dư thu được chất hữu cơ Y1 và Y1 phản ứng với brom (trong dung dịch, lượng dư) theo tỉ lệ mol 1 : 3.
 Xem đáp án
Xem đáp án
Đáp án A
0,26 mol X + dd MOH 20% 80,6 g (Y, Z) + 129,48 g H2O
® mY = 13,78 + 0,91.18 + 44.1,69 – 32.2,08 = 37,96 gam ® mZ = 80,6 – 37,96 = 42,64 gam
+ Vì đốt cháy Z1 tạo CO2, H2O với số mol bằng nhau
® Z1 là axit cacboxylic no, đơn chức => nZ = nHCl = 0,52 mol
® MZ = = 82 => muối Z là CH3COONa
nNaOH = => mNaOH = 31,2 gam
® mdd NaOH = 156 gam => = 156 – 31,2 = 124,8 gam
® Khối lượng H2O do X tạo ra = 129,48 – 124,8 = 4,68 gam (0,26 mol
+ Bảo toàn khối lượng => mX = 80,6 + 129,48 – 156 = 54,08 gam ® MX = 54,08 : 0,26 = 208.
+ Bảo toàn nguyên tố:
® Trong X: nC = 1,69 + 0,52.2 + 0,13 = 2,86
nH = 3.0,52 + 2.0,91 + 0,26.2 – 0,78 = 3,12
nO =
® Trong X thì nC : nH : nO = 2,86 : 3,12 : 1,04 = 11 : 12 : 4
® CTĐGN của X là C11H12O4.
Vì MX = 208 ® CTPT của X là C11H12O4
Vì C11H12O4 + 3NaOH → 2CH3COONa + Y + H2O
Mol 0,26 0,78 0,52 0,26
® CTPT của Y là C7H7O2Na
Theo tỉ lệ mol trên ® CTCT của X là CH3COOC6H4CH2OOCCH3
(3 đp: o, m, p)
Vì Y là HOCH2C6H4ONa → Y1 là HOCH2C6H4OH (3 đp: o, m, p)
+ Vì Y1 tác dụng với dd Brom dư theo tỉ lệ mol 1:3
® Y1 là m - HOCH2C6H4OH ® CTCT của X là m - CH3COOC6H4CH2OOCCH3Câu 38:
Hòa tan hoàn toàn m gam hỗn hợp chất rắn gồm CuSO4, CuCl2, NaCl và Na2SO4 vào nước thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư dung dịch Ba(OH)2 thu được 71,1 gam kết tủa. Mặt khác, khi điện phân một lượng dung dịch X như trên (điện cực trơ, có màng ngăn, hiệu suất 100%) với cường độ dòng điện 5A, thu được thể tích khí V (đktc) thoát ra ở hai điện cực phụ thuộc vào thời gian t như đồ thị bên.
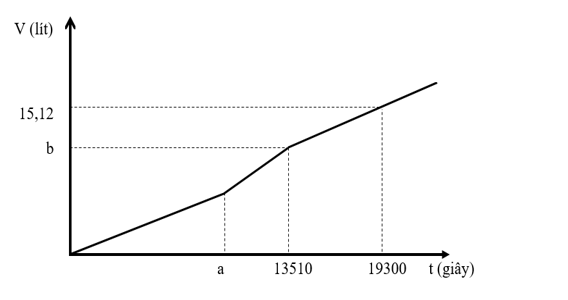
Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án A
Tại thời điểm 19300 giây, ne = I.t/F = 5.19300/96500 = 1 mol
® Ở (A): ne = 2nCl2 + 4nO2 => thu được: 0,35 mol Cl2 và 0,075 mol O2
+Tại 19300 giây điện phân, tổng số mol khí thu được ở 2 điện cực là 0,675 mol
nH2 = 0,675 – 0,35- 0,075 = 0,25 mol.
Ở (K): ne = 2nCu2+ + 2nH2 ® 1 = 2nCu2+ + 2.0,25 ® nCu2+ = 0,25 mol.
® Tại a giây điện phân, ne = 2nCu2+ = 0,5 mol ® 0,5 = 5.a/96500 ® a = 9650.
Tại 13510 giây điện phân:
Ở (K): ne = 2nCu2+ + 2nH2 => 0,7 = 2.0,25 =2nH2 ® nH2 = 0,1 mol
Ở (A) thu được: nCl2 = 0,35 mol.
® nCl2 + nH2 = 0,35 + 0,1 = 0,45 mol ® b = 0,45. 22,4 = 10,08 lít.
Khi cho dung dịch X tác dụng với lượng dư dung dịch Ba(OH)2 thu được kết tủa gồm: 0,25 mol Cu(OH)2 và BaSO4 ® 71,1 = 0,25.98 + 233.nBaSO4 ® nBaSO4 = 0,2 mol
Dung dịch X chứa: 0,25 mol Cu2+; 0,7 mol Cl-; 0,2 mol SO42- và x mol Na+
BTĐT ® 0,25.2 + x = 0,7.1 + 0,2.2 ® x = 0,6 ® m = 0,25.64 + 0,7.35,5 + 0,2.96 +0,6.23 = 73,85 gam.
Câu 39:
Cho sơ đồ các phản ứng sau:
(1) A + X + H2O → Ca(AlO2)2 + H2
(3) Ca(AlO2)2 + CO2 + H2O → G + E
(2) A + H2SO4 → Z + H2
(4) Z + Y → G + Na2SO4
(5) E + Y → CaCO3 + NaHCO3 + H2O
Nhận định về các chất ứng với các chữ cái A, X, Z, G, E như sau:
(a) A là chất có tính lưỡng tính.
(b) X là một bazơ mạnh dùng để sản xuất clorua vôi (CaOCl2), vật liệu xây dựng,
(c) Z là hợp chất có thành phần chính trong phèn chua.
(d) G là hợp chất kết tủa ở dạng keo và có tính lưỡng tính.
(e) E là hợp chất bền không bị phân hủy khi đun nóng và nguyên nhân làm cho nước có tính cứng tạm thời.
Số nhận định đúng là
 Xem đáp án
Xem đáp án
Đáp án A
(1)(2) → A là Al → X là Ca(OH)2; Z là Al2(SO4)3
(3)(5) → E là Ca(HCO3)2 → G là Al(OH)3; Y là NaOH
(a) Sai, Al không có tính axit hoặc bazơ.
(b) Đúng
(c) Đúng, phèn chua là K2SO4.Al2(SO4)3.24H2O
(d) Đúng
(e) Sai, E kém bền: Ca(HCO3)2 → CaCO3 + CO2 + H2O
Câu 40:
Cho E (C4H6O4) và F (C5H8O5) là các chất hữu cơ mạch hở. Từ E, F thực hiện sơ đồ các phản ứng sau (theo đúng tỉ lệ mol):
(1) E + 2NaOH → X + 2Y
(2) F + 2NaOH → X + Y + Z
(3) Y + HCl → T + NaCl
Biết X, Y, Z, T là các hợp chất hữu cơ. Cho các phát biểu sau:
(a) Chất X có số nguyên tử oxi bằng số nguyên tử cacbon.
(b) Phân tử chất Z chứa đồng thời nhóm -OH và nhóm -COONa.
(c) Chất X có thể được điều chế trực tiếp từ etilen.
(d) Nhiệt độ sôi của chất T nhỏ hơn nhiệt độ sôi của ancol etylic.
(e) 1 mol chất T tác dụng với Na dư thu được tối đa 1 mol khí H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
(3) → Y chứa Na
(1) → E là (HCOO)2C2H4; X là C2H4(OH)2; Y là HCOONa
→ T là HCOOH
(2) → F là HCOO-CH2-CH2-OOC-CH2-OH
Z là HO-CH2-COONa
(a) Đúng, X là C2H6O2
(b) Đúng
(c) Đúng: C2H4 + KMnO4 + H2O → C2H4(OH)2 + KOH + MnO2
(d) Sai, T có liên kết H liên phân tử bền hơn C2H5OH nên
