(2023) Đề thi thử Hóa Liên trường Nghệ An, Nghệ An ( Lần 3, Đề 2) có đáp án
(2023) Đề thi thử Hóa Liên trường Nghệ An, Nghệ An ( Lần 3, Đề 2) có đáp án
-
1033 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 2:
Có các chất sau: Amilozơ (1), Xenlulozơ (2), Saccarozơ (3), Tripanmitin (4). Khi thủy phân hoàn toàn các chất trên trong môi trường axit thì những chất nào chỉ tạo thành glucozơ?
 Xem đáp án
Xem đáp án
Amilozơ (1), Xenlulozơ (2) thủy phân hoàn toàn các chất trên trong môi trường axit thì những chất nào chỉ tạo thành glucozơ; Saccarozơ (3) tạo thành glucozơ và fructozơ.
Câu 5:
Nhiệt phân Fe(NO3)2 trong không khí đến khi khối lượng chất rắn không thay đổi, thu được
 Xem đáp án
Xem đáp án
Nhiệt phân Fe(NO3)2 trong không khí đến khi khối lượng chất rắn không thay đổi, thu được Fe2O3:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Câu 8:
Khí X là một chất có tính khử, rất độc và thường sinh ra khi đốt than trong phòng kín. X có công thức phân tử là
 Xem đáp án
Xem đáp án
Chọn A
Câu 9:
Tại một xưởng sản xuất đường thủ công, 1 tấn mía nguyên liệu được đưa vào máy ép, thu được 700 kg nước mía có nồng độ saccarozơ là 12%. Sau khi chế biến toàn bộ lượng nước mía này với hiệu suất 90%, thu được m kg đường saccarozơ. Giá trị của m là
 Xem đáp án
Xem đáp án
mSaccarozơ = 700.12%.90% = 75,6 kg
Câu 12:
Xăng sinh học E5 là sản phẩm thu được khi pha trộn xăng A92 với các nhiên liệu sinh học bio-etanol theo tỷ lệ thể tích 95:5. Xăng E5 được sử dụng làm nhiên liệu cho các loại động cơ đốt trong như xe máy, ô tô… Lí do khiến xăng E5 được khuyến khích sử dụng là
 Xem đáp án
Xem đáp án
Xăng E5 được khuyến khích sử dụng vì xăng sinh học E5 thân thiện với môi trường, hạn chế sự ô nhiễm:
+ Với cùng khối lượng, xăng E5 tiêu tốn ít O2 và phát thải ít CO2 hơn xăng thường.
+ Xăng sinh học góp phần phát triển kinh tế nông thôn (nguyên liệu sản xuất C2H5OH là sản phẩm nông nghiệp).
+ Xăng sinh học giúp đảm bảo an ninh năng lượng (dầu mỏ đang cạn kiệt dần và giá cả dễ biến động).
Câu 13:
Thủy phân este X trong dung dịch axit, thu được CH3COOH và CH3OH. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
X là CH3COOCH3:
CH3COOCH3 + H2O ⇌ CH3COOH + CH3OH (H+, t°)
Câu 15:
Cho sơ đồ phản ứng của các chất hữu cơ:
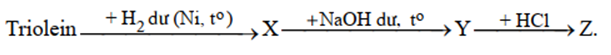
Tên của Z là
 Xem đáp án
Xem đáp án
(C17H33COO)3C3H5 + 3H2 → (C17H35COO)3C3H5
(C17H33COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
C17H35COONa + HCl → C17H35COOH + NaCl
→ Z là axit stearic.
Câu 16:
Cho các chất rắn: Fe, FeO, Fe3O4, Fe(NO3)2. Có bao nhiêu chất có khả năng khử HNO3 trong dung dịch HNO3 loãng?
 Xem đáp án
Xem đáp án
Cả 4 chất đều có khả năng khử HNO3 trong dung dịch HNO3 loãng:
Fe + HNO3 loãng → Fe(NO3)3 + NO + H2O
FeO + HNO3 loãng → Fe(NO3)3 + NO + H2O
Fe3O4 + HNO3 loãng → Fe(NO3)3 + NO + H2O
Fe(NO3)2 + HNO3 loãng → Fe(NO3)3 + NO + H2O
Câu 18:
Hòa tan m gam hỗn hợp Al, Na vào lượng nước dư. Sau khi kết thúc phản ứng thu được 7,84 lít khí (đktc) và còn 0,3m gam chất rắn không tan. Giá trị của m là
 Xem đáp án
Xem đáp án
Chất rắn không tan là Al dư.
Na + Al + 2H2O → NaAlO2 + 2H2
nH2 = 0,35 → nNa = nAl phản ứng = 0,175
→ m = 0,175.23 + 0,175.27 + 0,3m → m = 12,5
Câu 19:
Các kim loại nào sau đây là thành phần của hợp kim siêu nhẹ được dùng trong kĩ thuật hàng không?
 Xem đáp án
Xem đáp án
Chọn C
Câu 21:
Dung dịch X chứa 0,01 mol ClH3NCH2COOH; 0,02 mol CH3CH(NH2)COOH và 0,05 mol HCOOC6H5. Cho dung dịch X tác dụng với 160 ml dung dịch NaOH 1M đun nóng, sau phản ứng hoàn toàn cô cạn dung dịch thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
nNaOH ban đầu = 0,16
Chất rắn gồm GlyNa (0,01), NaCl (0,01), AlaNa (0,02), HCOONa (0,05), C6H5ONa (0,05) và NaOH dư (0,02)
→ m rắn = 13,775
Câu 22:
Ở điều kiện thường, kim loại nào sau đây tác dụng được với nước sinh ra khí H2?
 Xem đáp án
Xem đáp án
Chọn B
Câu 24:
Amoniac là chất khí dễ tan trong nước tạo thành dung dịch có tính bazơ. Amoniac được sử dụng nhiều trong công nghiêp cũng như trong phòng thí nghiệm. Công thức của amoniac là
 Xem đáp án
Xem đáp án
Chọn A
Câu 25:
Cho dãy các polime gồm: tơ visco, tơ olon, polistiren, poli(vinyl clorua), tơ axetat, cao su buna. Số polime được tổng hợp từ phản ứng trùng hợp là:
 Xem đáp án
Xem đáp án
Các polime được tổng hợp từ phản ứng trùng hợp là:
tơ olon, polistiren, poli(vinyl clorua), cao su buna.
Câu 26:
Hấp thụ hoàn toàn 5,6 lít CO2 (đktc) vào 400ml dung dịch NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Làm khô cẩn thận dung dịch X, thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
nH2CO3 = nCO2 = 0,25; nNaOH = 0,4
1 < nOH-/nCO2 < 2 nên X chứa 2 muối → nH2O = nOH- = 0,4
Bảo toàn khối lượng:
m muối = 0,25.62 + 0,4.40 – 0,4.18 = 24,3 gam
Câu 27:
Al có thể tan hết hoàn toàn trong dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Al có thể tan hết hoàn toàn trong dung dịch HCl đặc nguội:
Al + HCl → AlCl3 + H2
Câu 28:
Trong công nghiệp các kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Các kim loại thuộc nhóm IA, IIA và Al được điều chế bằng phương pháp điện phân nóng chảy → Chọn B.
Câu 29:
Cho m gam hỗn hợp X chứa các triglixerit và axit béo tác dụng vừa đủ với 300 ml dung dịch NaOH 1M, đun nóng thu được 1,05m gam hỗn hợp muối của các axit béo no. Mặt khác, đốt cháy hoàn toàn m gam X cần dùng 6,1 mol O2. Giá trị gần nhất của m là
 Xem đáp án
Xem đáp án
Quy đổi X thành HCOOH (0,3), CH2 (a), C3H5(OH)3 (b), H2O (-3b)
→ m = 0,3.46 + 14a + 92b – 18.3b
m muối = 0,3.68 + 14a = 1,05m
nO2 = 0,3.0,5 + 1,5a + 3,5b = 6,1
→ a = 3,7756; b = 0,08188; m = 69,77
Câu 30:
Hòa tan hỗn hợp gồm A gồm x gam CuSO4 và y gam NaCl vào nước thu được dung dịch Z. Tiến hành điện phân Z với điện cực trơ, màng ngăn xốp, dòng điện có cường độ không đổi. Tổng số mol khí thu được ở cả hai điện cực (n) phụ thuộc vào thời gian điện phân (t) được mô tả như đồ thị bên.
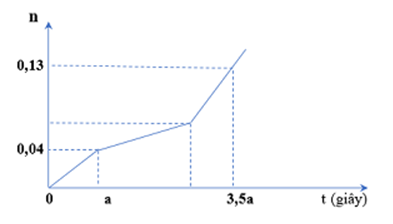
Giả thiết hiệu suất điện phân là 100%, bỏ qua sự bay hơi của nước. Giá trị của tổng (x + y) là
 Xem đáp án
Xem đáp án
Đoạn 1: nCl2 = 0,04
Trong a giây mỗi điện cực đã trao đổi 0,04.2 = 0,08 mol electron.
Đoạn 2: Có độ dốc nhỏ hơn đoạn 1 nên tốc độ thoát khí chậm lại → Thoát O2 (u mol)
Đoạn 3: Thoát H2 và O2. Đặt nO2 = v → nH2 = 2v
n khí tổng = u + 3v + 0,04 = 0,13
ne anot = 2.0,04 + 4(u + v) = 0,08.3,5
→ u = 0,03 và v = 0,02
2nCu = 2nCl2 + 4nO2 (đoạn 2) → nCu = 0,1 → nCuSO4 = 0,1
nNaCl = 2nCl2 = 0,08
→ x + y = mA = 20,68 gam
Câu 31:
Cho sơ đồ chuyển hóa giữa các hợp chất hữu cơ:
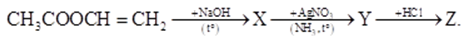
Công thức cấu tạo của Z là
 Xem đáp án
Xem đáp án
X có tráng gương nên X là CH3CHO
→ Y là CH3COONH4 → Z là CH3COOH
Câu 32:
Nhiệt phân hoàn toàn 33,32 gam muối X (là muối ở dạng ngậm nước) thu được hỗn hợp Y gồm khí và hơi và 5,6 gam một chất rắn Z. Hấp thụ toàn bộ Y vào nước thu được dung dịch T. Cho 280 ml dung dịch NaOH 1M vào T thu được dung dịch chỉ chứa một muối duy nhất, khối lượng muối là 23,80 gam. Phần trăm khối lượng nguyên tố kim loại trong X là
 Xem đáp án
Xem đáp án
nNaOH = 0,28
Muối khan có k nguyên tử Na → n muối = 0,28/k
→ M muối = 23,8k/0,28 = 85k
→ k = 1, M muối = 85: Muối là NaNO3 (0,28)
Y hấp thụ hết vào H2O → Y gồm NO2 (0,28), O2 (0,07) và hơi H2O
mY = mX – mZ = 27,72 → mH2O = 12,6 gam
Vậy X chứa cation kim loại, NO3- (0,28 mol) và H2O (12,6 gam)
→ m kim loại = mX – mNO3- – mH2O = 3,36
→ %kim loại = 3,36/33,32 = 10,08%
Câu 33:
Tiến hành các thí nghiệm sau:
(a) Dẫn từ từ khí 1,5x mol CO2 vào dung dịch chứa x mol Ba(OH)2.
(b) Cho từ từ 1,5a mol khí CO2 vào dung dịch chứa hỗn hợp a mol NaOH và a mol Ca(OH)2.
(c) Cho dung dịch chứa a mol NaHCO3 vào dung dịch chứa a mol KOH.
(d) Hấp thụ hết 3 mol khí CO2 vào dung dịch chứa 2 mol NaOH.
(e) Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa a mol Ca(HCO3)2.
Số thí nghiệm sau khi kết thúc thu được dung dịch có chứa hai muối là
 Xem đáp án
Xem đáp án
Chọn C
Câu 34:
Biết khi đốt cháy 1 mol tristearin và 1 mol triolein toả ra lượng nhiệt lần lượt là 35 807 kJ và 34 950 kJ. Tính lượng nhiệt thu được khi đốt cháy 1kg loại chất béo có 30% là tristearin và 60 % triolein, còn lại tạp chất không sinh nhiệt.
 Xem đáp án
Xem đáp án
Nhiệt lượng khi đốt cháy 1000 gam chất béo:
35807.30%.1000/890 + 34950.60%.1000/884 = 35791 kJ
Câu 35:
Nung nóng a mol hỗn hợp X gồm C2H2 và H2 trong bình kín có xúc tác thích hợp thu được hỗn hợp khí Y. Dẫn Y qua lượng dư dung dịch AgNO3 trong NH3, sau khi phản ứng hoàn toàn thu được 36 gam kết tủa và hỗn hợp khí Z. Hỗn hợp Z làm mất màu tối đa 60 gam brom trong dung dịch và còn lại hỗn hợp khí T. Đốt cháy hoàn toàn T thu được 17,55 gam nước. Vậy giá trị của a là
 Xem đáp án
Xem đáp án
Y gồm C2H2 dư, C2H4, C2H6 và H2 dư
nC2H2 dư = nAg2C2 = 0,15
nC2H4 = nBr2 = 0,375
Hỗn hợp T còn C2H6 và H2 dư
nH2O = 3nC2H6 + nH2 dư = 0,975 (1)
nC2H2 ban đầu = nC2H2 dư + nC2H4 + nC2H6
nH2 ban đầu = nH2 dư + nC2H4 + 2nC2H6
Cộng 2 vế phương trình ta có:
a = nC2H2 dư + 2nC2H4 + 3nC2H6 + nH2 dư
Thế (1) → a = 0,15 + 0,375.2 + 0,975 = 1,875
Câu 36:
Sau khi phân tích thổ nhưỡng vùng đất trồng lạc (đậu phộng) của một tỉnh X, chuyên gia nông nghiệp khuyến nghị bà con nông dân cần bón bổ sung 40 kg N, 45 kg P và 66 kg K cho mỗi ha. Loại phân mà người nông dân sử dụng là phân hỗn hợp NPK (13 – 13 – 13) trộn với phân kali KCl (độ dinh dưỡng 60%) và một loại supephotphat (độ dinh dưỡng 17%). Theo khuyến nghị trên, tổng khối lượng phân bón đã sử dụng cho 1 ha gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Khối lượng mỗi loại phân là NPK (x kg), phân kali (y kg) và supephotphat (z kg)
mN = 40 = 13%x
mP = 45 = 31.2.13%x/142 + 31.2.17%z/142
mK = 66 = 39.2.13%x/94 + 39.2.60%y/94
→ x = 307,69; y = 65,90; z = 370,97
→ x + y + z = 744,56
Câu 37:
Cho các phát biểu sau:
(a) Tất cả các kim loại thuộc nhóm IA đều dễ tan trong nước tạo dung dịch bazơ tương ứng.
(b) Cho FeCl2 vào dung dịch AgNO3 dư thu được hỗn hợp chất rắn.
(c) Au là kim loại có khả năng dẫn điện tốt nhất.
(d) Phèn chua được dùng để làm trong nước đục.
(e) Có thể dùng lượng vừa đủ dung dịch HCl để làm mềm nước cứng tạm thời.
(g) Hỗn hợp Cu và Fe2O3 (tỉ lệ mol 1:1) có thể tan hoàn toàn dung dịch HCl dư.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng: FeCl2 + AgNO3 → Fe(NO3)3 + AgCl + Ag
(c) Sai, Ag là kim loại có khả năng dẫn điện tốt nhất.
(d) Đúng, phèn chua KAl(SO4)2.12H2O chứa Al3+ bị thủy phân tạo kết tủa keo Al(OH)3 kết dính các chất bẩn lơ lửng và lắng xuống.
(e) Sai, HCl không tạo kết tủa với Ca2+, Mg2+.
(g) Đúng: Cu + Fe2O3 + 6HCl → CuCl2 + 2FeCl2 + 3H2O
Câu 38:
Tiến hành thí nghiệm theo các bước sau:
- Bước 1: Cho từ từ dung dịch NH3 tới dư vào ống nghiệm (1) chứa 1 ml dung dịch AgNO3 đến khi kết tủa tan hết.
- Bước 2: Thêm 0,5 ml dung dịch H2SO4 loãng vào ống nghiệm (2) chứa 2ml dung dịch saccarozơ 15%. Đun nóng dung dịch trong 3 – 5 phút, rồi để nguội hỗn hợp.
- Bước 3: Thêm từ từ dung dịch NaHCO3 vào ống nghiệm (2) khuấy đều đến khi không còn sủi bọt khí CO2.
- Bước 4: Rót từ từ dung dịch trong ống nghiệm (2) vào ống nghiệm (1), đun nhẹ đến khi thấy kết tủa bám trên thành ống nghiệm.
Cho các phát biểu dưới đây:
(1) Sau bước 1, dung dịch trong ống nghiệm (1) có màu xanh lam.
(2) Ở bước 2 dung dịch H2SO4 loãng làm môi trường cho quá trình thủy phân saccarozơ.
(3) Khí CO2 sinh ra ở bước 3 là do NaHCO3 bị nhiệt phân.
(4) Ở bước 4, kết tủa bám lên thành ống nghiệm là Ag2SO4.
(5) Thí nghiệm trên chứng minh saccarozơ là có tính oxi hóa.
(6) Phản ứng tráng gương trong bước 4 là phản ứng oxi hóa khử.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Bước 1: Tạo phức bạc để chuẩn bị phản ứng tráng gương.
Bước 2: Thủy phân saccarozơ trong môi trường H2SO4.
Bước 3: Loại bỏ H2SO4 trong dung dịch sau thủy phân.
Bước 4: Thựa hiện phản ứng tráng gương.
(1) Sai, phức bạc không có màu.
(2) Đúng, H2SO4 tạo môi trường axit, xúc tác cho quá trình thủy phân saccarozơ.
(3) Sai, CO2 sinh ra do NaHCO3 + H2SO4 → Na2SO4 + CO2 + H2O
(4) Sai, kết tủa bám trên thành ống nghiệm là Ag
(5) Sai, thí nghiệm chứng minh saccarozơ bị thủy phân.
(6) Đúng, phản ứng tráng gương là phản ứng oxi hóa khử.
Câu 39:
Cho các chất: glyxylalanin, vinyl axetat, etyl fomat, metyl acrylat, saccarozơ, xenlulozơ. Số chất bị thủy phân hoàn toàn trong môi trường axit thu được sản phẩm có phản ứng tráng bạc là
 Xem đáp án
Xem đáp án
Các chất bị thủy phân hoàn toàn trong môi trường axit thu được sản phẩm (trong dấu ngoặc) có phản ứng tráng bạc là:
vinyl axetat (CH3CHO), etyl fomat (HCOOH), saccarozơ (glucozơ, fructozơ), xenlulozơ (glucozơ).
Câu 40:
Hỗn hợp X gồm ba este mạch hở Y, Z, T trong đó có một este hai chức và hai este đơn chức (MY < MZ < MT). Đốt cháy hoàn toàn 20,04 gam X cần dùng vừa hết 0,79 mol O2; hấp thụ toàn bộ sản phẩm cháy vào bình chứa một lượng dư dung dịch nước vôi trong thu được 76,0 gam kết tủa và khối lượng dung dịch sau phản ứng giảm đi 30,68 gam so với trước phản ứng. Nếu cho 20,04 gam X tác dụng với một lượng dư NaOH thì thu được hỗn hợp gồm các ancol no và 22,08 gam hỗn hợp muối của hai axit cacboxylic kế tiếp nhau trong dãy đồng đẳng. Công thức phân tử chất Z, T là
 Xem đáp án
Xem đáp án
Ca(OH)2 dư → nCO2 = nCaCO3 = 0,76
Δm = mCO2 + mH2O – mCaCO3 = -30,68
→ nH2O = 0,66
nO(X) = (mX – mC – mH)/16 = 0,6
→ n muối = nNaOH = 0,3 → M muối = 73,6
→ Muối gồm HCOONa (0,18) và CH3COONa (0,12)
nEste đôi = nCO2 – nH2O = 0,1
→ nEste đơn = 0,3 – 0,1.2 = 0,1
→ X gồm (HCOO)(CH3COO)A (0,1 mol), HCOOB (0,08 mol) và CH3COOR (0,02 mol) với a, b, r là số C tương ứng của các gốc -A-, -B, -R
nC = 0,1(a + 3) + 0,08(b + 1) + 0,02(r + 2) = 0,76
→ 5a + 4b + r = 17
Với a ≥ 2, b ≥ 1, r ≥ 1 → a = 2, b = 1, r = 3 là nghiệm duy nhất.
Y là HCOOCH3: 0,08 mol
Z là CH3COOC3H7: 0,02 mol (C5H10O2)
T là (HCOO)(CH3COO)C2H4: 0,1 mol (C5H8O4)
