Trắc nghiệm tổng hợp ôn thi tốt nghiệp THPT môn Hóa Bài 11. Nguồn điện hoá học có đáp án
Trắc nghiệm tổng hợp ôn thi tốt nghiệp THPT môn Hóa Bài 11. Nguồn điện hoá học có đáp án
-
95 lượt thi
-
42 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 2:
Cho các phản ứng hoá học sau:
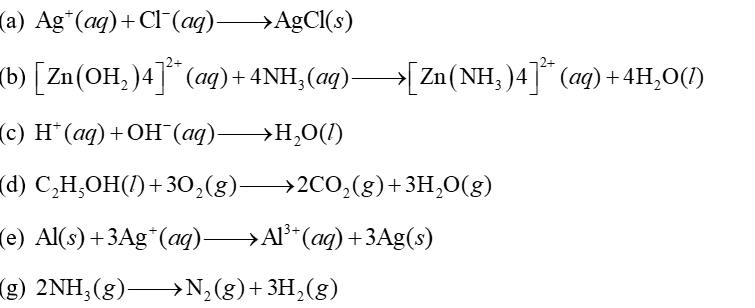
Số phản ứng có thể chuyển hoá năng lượng phản ứng thành điện năng thông qua việc lập các pin điện hoá là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 3:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 4:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 5:
Trong pin Galvani X-Y có phản ứng chung là:
Quá trình xảy ra tại cathode (hay cực dương) của pin là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 6:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 7:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 8:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 9:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 10:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 11:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 12:
Cho biết sức điện động chuẩn của các pin sau:
|
Pin điện hoá |
X-Y |
M-Y |
M-Z |
|
Sức điện động chuẩn (V) |
0,20 |
0,60 |
0,30 |
Sự sắp xếp nào sau đây đúng với tính khử của các kim loại \({\rm{X}},{\rm{Y}},{\rm{Z}},{\rm{M}}\) ?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 13:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 14:
Cho biết thế điện cực chuẩn của các cặp oxi hoá - khử sau:
|
Cặp oxi hoá - khử |
\({\rm{M}}{{\rm{g}}^{2 + }}/{\rm{Mg}}\) |
\({\rm{Z}}{{\rm{n}}^{2 + }}/{\rm{Zn}}\) |
\({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\) |
\({\rm{A}}{{\rm{g}}^ + }/{\rm{Ag}}\) |
\({\rm{H}}{{\rm{g}}^{2 + }}/{\rm{Hg}}\) |
|
\({\rm{E}}_{{\rm{oxh }}/{\rm{kh}}}^{\rm{o}}({\rm{V}})\) |
\( - 2,356\) |
\( - 0,763\) |
0,340 |
0,799 |
0,854 |
Một trong số các pin trên có sức điện động chuẩn là \(3,21\;{\rm{V}}.\) Pin nào sau đây ứng với giá trị đó?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 15:
Cho thế điện cực chuẩn của một số kim loại như sau:
|
Cặp oxi hoá – khử |
\({\rm{M}}{{\rm{g}}^{2 + }}/{\rm{Mg}}\) |
\({\rm{Z}}{{\rm{n}}^{2 + }}/{\rm{Zn}}\) |
\({\rm{P}}{{\rm{b}}^{2 + }}/{\rm{Pb}}\) |
\({\rm{C}}{{\rm{u}}^{2 + }}/{\rm{Cu}}\) |
\({\rm{H}}{{\rm{g}}^{2 + }}/{\rm{Hg}}\) |
|
\({\rm{E}}_{{\rm{oxh }}/{\rm{kh}}}^o(\;{\rm{V}})\) |
\( - 2,356\) |
\( - 0,763\) |
\( - 0,126\) |
0,340 |
0,854 |
Kết luận nào sau đây là không đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 16:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 17:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 18:
Pin quả chanh được thiếp lập gồm một dây Cu và dây Zn ghim vào một quả chanh và nối với bóng điện như hình bên. Bóng điện sáng đồng nghĩa với sự xuất hiện dòng điện. Bán phản ứng nào sau đây xảy ra ở cực dương?

 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 19:
Phản ứng xảy ra khi sạc của một pin Li-ion là:
Để có được một pin điện có dung lượng là 4000 mAh thì khối lượng \({\rm{LiCo}}{{\rm{O}}_2}\) tối thiểu trước khi sạc là bao nhiêu?
Cho biết: \({{\rm{M}}_{{\rm{LiCo}}{{\rm{O}}_2}}} = 97,874\;{\rm{g}}/{\rm{mol}};1\;{\rm{mol}}\) điện lượng là 96485 C và \(1{\rm{C}} = 1\) A.s.
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 20:
Phản ứng của acquy chì khi sạc điện là:
\(2{\rm{PbS}}{{\rm{O}}_4}(s) + 2{{\rm{H}}_2}{\rm{O}}(l) \to {\rm{Pb}}(s) + {\rm{Pb}}{{\rm{O}}_2}(s) + 2{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}(aq)\)
Chất được sinh ra ở cực âm khi acquy chì sạc điện là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 21:
Phản ứng của acquy chì khi xả điện là:
Khi đó, Pb sẽ bị oxi hoá và tạo thành \({\rm{PbS}}{{\rm{O}}_4}\) bám vào điện cực và \({\rm{Pb}}{{\rm{O}}_2}\) bị khử thành \({\rm{PbS}}{{\rm{O}}_4}\) bám vào điện cực. Phát biểu nào sau đây đúng trong quá trình acquy xả điện?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 22:
Pin nhiên liệu đang được đặc biệt quan tâm nghiên cứu vì tiềm năng sử dụng trong tương lai do có nhiều ưu điểm so với pin Galvani hiện nay. Dòng điện tạo ra trong pin do phản ứng oxi hoá nhiên liệu \(\left( {{{\rm{H}}_2},{\rm{C}}{{\rm{H}}_3}{\rm{OH}},{\rm{C}}{{\rm{H}}_4}, \ldots } \right)\) bằng \({{\rm{O}}_2}\) của không khí. Ưu điểm của pin là sản sinh dòng điện với hiệu suất cao.
Cấu tạo và cơ chế hoạt động của pin nhiên liệu hydrogen như sau:
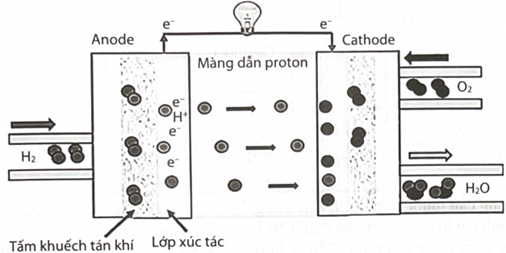
Phản ứng chung trong pin nhiên liệu hydrogen là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 26:
d. Sức điện động của pin không thay đổi cho đến khi phản ứng trong pin xảy ra hoàn toàn.
 Xem đáp án
Xem đáp án
Sai
Câu 28:
b. Sức điện động của pin ở 298 K là \(0,597\;{\rm{V}}\) và không đổi cho đến khi pin ngừng hoạt động.
 Xem đáp án
Xem đáp án
Sai
Câu 30:
d. Khối lượng điện cực Ni và Cu không thay đổi trong quá trình pin hoạt động.
 Xem đáp án
Xem đáp án
Sai
Câu 37:
b. Các pin nhiên liệu hoạt động dựa trên các phản ứng oxi hoá hoàn toàn các nhiên liệu.
 Xem đáp án
Xem đáp án
Đúng
Câu 38:
c. Phản ứng trong các pin nhiên liệu methanol-oxygen là phản ứng oxi hoá methanol bởi khí O2 thành fomaldehyde.
 Xem đáp án
Xem đáp án
Sai
Câu 39:
d. Các acquy được sạc lại bằng cách nối cùng cực (âm với âm, dương với dương) của dòng điện một chiều.
 Xem đáp án
Xem đáp án
Đúng
Câu 41:
Điện lượng (q) là một đại lượng đặc trưng cho lượng electron mà các điện cực trao đổi trong pin điện. Khi đó, điện lượng được xác định bởi biểu thức sau:
\({\rm{q}} = \) số mol electron \( \times {\rm{F}}\) (F là 1 mol điện lượng, \({\rm{F}} = 96485{\rm{C}}/{\rm{mol}}\)).
Một pin điện hoá được cấu tạo như sau:
Thanh kẽm \(({\rm{Zn}})\) nhúng vào 100 mL dung dịch \({\rm{ZnS}}{{\rm{O}}_4}0,1{\rm{M}}.\)
Thanh đồng \(({\rm{Cu}})\) nhúng vào 100 mL dung dịch \({\rm{CuS}}{{\rm{O}}_4}0,1{\rm{M}}.\)
Hai thanh kim loại được nối bằng dây dẫn với một thiết bị tiêu thụ điện và hai dung dịch nối với nhau bằng cầu muối. Phản ứng dừng lại khi \({\rm{C}}{{\rm{u}}^{2 + }}\) trong dung dịch bị khử hết thành Cu. Điện lượng (tính theo C) mà pin đó đã sản sinh là bao nhiêu?
(Làm tròn kết quả đến hàng đơn vị)
 Xem đáp án
Xem đáp án
Số \({\rm{molC}}{{\rm{u}}^{2 + }} = 0,1\;{\rm{mol}};{\rm{C}}{{\rm{u}}^{2 + }} + 2{\rm{e}} \to {\rm{Cu}}\)
\( \Rightarrow \) điện lượng mà pin sản \(\sinh = 0,02 \times {\rm{F}} = 1929,7{\rm{C}} = 1930{\rm{C}}\).
Câu 42:
Một máy điện sử dụng các pin nhiên liệu để phát điện với nguyên liệu là khí hydrogen và có hiệu suất điện là 56 % (nghĩa là có 56 % năng lượng của phản ứng chuyển hoá thành điện năng). Mỗi ngày nhà máy sản xuất được 500 kWh. Tính khối lượng (theo kg) khí hydrogen tiêu thụ? (Làm tròn kết quả đến hàng phần mười)
Cho biết: \(\Delta {\rm{fH}}_{298}^0\left( {{{\rm{H}}_2}{\rm{O}}(l)} \right) = - 285,84\;{\rm{kJ}} \cdot {\rm{mo}}{{\rm{l}}^{ - 1}};1{\rm{kWh}} = 3,{6.10^6}\;{\rm{J}};{{\rm{M}}_{{{\rm{H}}_2}}} = 2\;{\rm{g}}/{\rm{mol}}.\)
 Xem đáp án
Xem đáp án
Xét phản ứng: \({{\rm{H}}_2}(g) + 0,5{{\rm{O}}_2}(g) \to {{\rm{H}}_2}{\rm{O}}(l)\)
\({\rm{A}} = {\rm{h}}\% \frac{{{\Delta _{\rm{r}}}{{\rm{H}}^o }}}{{100\% }} \cdot {{\rm{n}}_{{{\rm{H}}_2}}}\)\( \Rightarrow {{\rm{n}}_{{{\rm{H}}_2}}} = \frac{{\rm{A}}}{{{\rm{h}}\% \cdot {\Delta _{\rm{r}}}{{\rm{H}}^o}}} \cdot 100\% = \frac{{500 \cdot 3,6 \cdot {{10}^6}\;{\rm{J}}}}{{0,56 \cdot 285,84 \cdot {{10}^3}\;{\rm{J}}\;{\rm{mo}}{{\rm{l}}^{ - 1}}}} = 11245(\;{\rm{mol}}) = 11,245{\rm{kmol}}\)
Khối lượng \({{\rm{H}}_2}\) tiêu thụ mỗi ngày là: \(2 \cdot 11,245 = 22,49(\;{\rm{kg}}) \approx 22,5\;{\rm{kg}}\).
