(2023) Đề thi thử Hóa THPT Yên Lạc 2, Vĩnh Phúc (Lần 3) có đáp án
(2023) Đề thi thử Hóa THPT Yên Lạc 2, Vĩnh Phúc (Lần 3) có đáp án
-
483 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 2:
Hiện tượng trái đất nóng lên do hiệu ứng nhà kính chủ yếu là do chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C
Câu 3:
Miếng chuối xanh tác dụng với dung dịch iot cho màu xanh do chuối xanh có chứa
 Xem đáp án
Xem đáp án
Chọn B
Câu 11:
Phenol phản ứng được với dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Phenol phản ứng được với dung dịch KOH, ví dụ:
C6H5OH + KOH → C6H5OK + H2O
Câu 14:
Các bể đựng nước vôi trong để lâu ngày thường có một lớp màng cứng rất mỏng trên bề mặt, chạm nhẹ tay vào đó, lớp màng sẽ vỡ ra. Thành phần chính của lớp màng cứng này là
 Xem đáp án
Xem đáp án
Không khí có chứa CO2 nên tại bề mặt tiếp xúc giữa nước vôi và không khí xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
→ Thành phần chính của lớp màng cứng này là CaCO3.
Câu 15:
Etyl fomat là chất mùi thơm, không độc, được dùng làm chất tạo hương trong công nghiệp thực phẩm. CTPT của etyl fomat là
 Xem đáp án
Xem đáp án
Chọn D
Câu 16:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
A. Sai, thủy phân etyl axetat (CH3COOC2H5) thu được ancol etylic (C2H5OH).
B. Đúng, etyl fomat (HCOOC2H5) có thể viết dưới dạng C2H5-O-CHO nên có tráng bạc.
C. Đúng, triolein (C17H33COO)3C3H5 là chất béo không no, thể lỏng ở điều kiện thường.
D. Đúng, tristearin (C17H35COO)3C3H5 là chất béo no, không phản ứng với nước brom.
Câu 20:
Trong các chất sau, chất nào là amin bậc 2?
 Xem đáp án
Xem đáp án
Khi thay thế 2H trong NH3 bằng 2 gốc hiđrocacbon ta được amin bậc II.
→ CH3NHCH3 là amin bậc II.
Câu 21:
Cấu hình electron nào sau đây là của ion Fe2+?
 Xem đáp án
Xem đáp án
Fe (Z = 26) có cấu hình: [Ar] 3d6 4s2
→ Fe2+ có cấu hình [Ar] 3d6
Câu 22:
Điện phân hoàn toàn 2,22 gam muối clorua kim loại ở trạng thái nóng chảy thu được 448 ml khí (ở đktc) ở anot. Kim loại trong muối là
 Xem đáp án
Xem đáp án
nCl2 = 0,02 → nRClx = 0,04/x
→ M = R + 35,5x = 2,22x/0,04
→ R = 20x
→ x = 2, R = 40: R là Ca
Câu 23:
Hoà tan m gam Al bằng dung dịch HCl (dư), thu được 3,36 lít H2 (ở đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
2Al + 6HCl → 2AlCl3 + 3H2
nH2 = 0,15 → nAl = 0,1 → mAl = 2,7 gam
Câu 24:
Cho 17,6 gam etyl axetat tác dụng hoàn toàn với 300ml dung dịch NaOH 1M, cô cạn thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
nCH3COOC2H5 = 0,2 và nNaOH = 0,3
→ Chất rắn gồm CH3COONa (0,2) và NaOH dư (0,1)
→ m rắn = 20,4
Câu 25:
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M, thu được 2V ml dung dịch Y. Dung dịch Y có pH bằng
 Xem đáp án
Xem đáp án
nOH- = 0,01V
nH+ = 0,03V
→ nH+ dư = 0,02V
→ [H+] = 0,02V/2V = 0,01 → pH = 2
Câu 26:
Cho 0,1 mol hỗn hợp C2H5NH2 và NH2CH2COOH tác dụng vừa đủ với V ml dung dịch HCl 1M. Giá trị của V là
 Xem đáp án
Xem đáp án
C2H5NH2 + HCl → C2H5NH3Cl
H2NCH2COOH + HCl → ClH3NCH2COOH
→ nHCl = 0,1 → V = 100 ml
Câu 27:
Hấp thụ hoàn toàn 2,24 lít khí CO2 (ở đktc) vào dung dịch chứa 8 gam NaOH, thu được dung dịch X. Khối lượng muối tan có trong dung dịch X là
 Xem đáp án
Xem đáp án
nCO2 = 0,1; nNaOH = 0,2 → Vừa đủ cho phản ứng:
CO2 + 2NaOH → Na2CO3 + H2O
nNa2CO3 = 0,1 → mNa2CO3 = 10,6 gam
Câu 28:
Số đồng phân este ứng với công thức phân tử C4H8O2 là
 Xem đáp án
Xem đáp án
Các đồng phân Este:
HCOO-CH2-CH2-CH3
HCOO-CH(CH3)2
CH3-COO-CH2-CH3
CH3-CH2-COO-CH3
Câu 29:
Cho sơ đồ chuyển hoá: Fe + X → FeCl3; FeCl3 + Y → Fe(OH)3 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
 Xem đáp án
Xem đáp án
Fe + X → FeCl3 nên X là Cl2
Y là NaOH.
Câu 30:
Cho các chất: phenol, anilin; saccarozơ, glyxin, axit glutamic, axit axetic, andehit fomic. Số chất tác dụng được với dung dịch NaOH là
 Xem đáp án
Xem đáp án
Các chất tác dụng được với dung dịch NaOH là:
phenol, glyxin, axit glutamic, axit axetic
Câu 31:
Khử hoàn toàn 16 gam Fe2O3 bằng khí CO ở nhiệt độ cao. Khí đi ra sau phản ứng được dẫn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Fe2O3 + 3CO → 3CO2 + 2Fe
0,1……………….0,3
CO2 + Ca(OH)2 dư → CaCO3 + H2O
0,3……………………0,3
→ mCaCO3 = 30 gam
Câu 32:
Trường hợp nào sau đây xảy ra quá trình ăn mòn điện hóa?
 Xem đáp án
Xem đáp án
A. Không có ăn mòn điện hóa vì không có cặp điện cực và môi trường điện li.
B. Không có ăn mòn điện hóa vì không có cặp điện cực.
C. Có ăn mòn điện hóa vì có cặp điện cực Fe-C tiếp xúc với môi trường điện li là không khí ẩm.
D. Không có ăn mòn điện hóa vì không có cặp điện cực.
Câu 33:
Đun nóng dung dịch chứa 27 gam glucozơ với dung dịch AgNO3/NH3 dư (hiệu suất phản ứng 100%) thì khối lượng Ag thu được tối đa là
 Xem đáp án
Xem đáp án
nAg = 2nC6H12O6 = 0,3
→ mAg = 32,4 gam
Câu 34:
Một loại khí thiên nhiên (X) có thành ứng phần phần trăm về thể tích như sau: 85,0% metan, 10,0% etan, 2,0% nitơ, 3,0% khí cacbonic. Biết rằng: khi đốt cháy 1 mol metan, 1 mol etan thì lượng nhiệt tỏa ra tương ứng là 880,0 kJ và 1560,0 kJ, để nâng 1 ml nước lên thêm 1°C cần 4,2 J. Giả thiết rằng lượng nhiệt tỏa ra của quá trình đốt cháy X dùng để làm nóng nước với hiệu suất hấp thụ nhiệt khoảng 80%. Thể tích khí X (đktc) cần dùng để đun nóng 10,0 lít nước (khối lượng riêng của nước 1g/ml) từ 20°C lên 100°C gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nX = x → nCH4 = 0,85x; nC2H6 = 0,1x
Bảo toàn năng lượng:
(0,85x.880.10³ + 0,1x.1560.10³).80% = 10.10³.4,2(100 – 20)
→ x = 4,646 → V = 104,07 lít
Câu 35:
Đốt cháy hoàn toàn 0,6 mol hỗn hợp E chứa ancol X; este đơn chức Y và anđehit Z (X, Y, Z đều no, mạch hở và có cùng số nguyên tử hiđro) có tỉ lệ mol tương ứng 3 : 1 : 2 thu được 24,64 lít CO2 (đktc) và 21,6 gam nước. Mặt khác cho 0,6 mol hỗn hợp E trên tác dụng với dung dịch AgNO3 dư trong NH3, đun nóng thu được m gam Ag. Giá trị m là
 Xem đáp án
Xem đáp án
nH2O = 1,2 → Số H = 2nH2O/nE = 4
Các chất có cùng số H nên E gồm:
X là CH3OH (3a mol)
Y là HCOOCH3 (a mol)
Z là CnH4Oz (2a mol)
→ nE = 3a + a + 2a = 0,6 → a = 0,1
nCO2 = 3a + 2a + 2na = 1,1 → n = 3
Z no, mạch hở nên Z là OHC-CH2-CHO
nAg = 2nY + 4nZ = 1 mol
→ mAg = 108 gam
Câu 36:
Cho các phát biểu sau
(1) Polietilen được điều chế bằng phản ứng trùng ngưng.
(2) Ở điều kiện thường, anilin là chất khí.
(3) Tinh bột thuộc loại polisaccarit.
(4) Ở điều kiện thích hợp, triolein tham gia phản ứng cộng H2.
(5) Tripeptit Gly-Ala-Gly có phản ứng màu biure.
(6) Liên kết peptit là liên kết -CO-NH- giữa hai đơn vị α-aminoaxit.
(7) Các dung dịch glyxin, alanin và lysin đều không làm đổi màu quỳ tím.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1) Sai, điều chế bằng trùng hợp
(2) Sai, anilin là chất lỏng
(3) Đúng
(4) Đúng
(5) Đúng
(6) Đúng
(7) Sai, Lys làm quỳ tím hóa xanh.
Câu 37:
Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 96,55 gam muối sunfat trung hòa (không chứa Fe3+) và khí Z gồm (0,1 mol NO + 0,075 mol H2). Phần trăm số mol của Mg trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng → nH2O = 0,55
Bảo toàn H → nNH4+ = 0,05
Bảo toàn N → nFe(NO3)2 = 0,075
nH+ = 4nNO + 10nNH4+ + 2nH2 + 2nO trong oxit
→ nO trong oxit = 0,2 → nZnO = 0,2
Đặt a, b là số mol Mg và Al
→ mX = 24a + 27b + 0,2.81 + 0,075.180 = 38,55
ne = 2a + 3b = 0,1.3 + 0,075.2 + 0,05.8
→ a = 0,2 và b = 0,15
→ %nMg = 0,2/(0,2 + 0,15 + 0,2 + 0,075) = 32%
Câu 38:
Hòa tan hoàn toàn a gam hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 vào nước, thu được dung dịch X. Cho một lượng Cu dư vào X thu được dung dịch Y có chứa b gam muối. Cho một lượng Fe dư vào Y, thu được dung dịch Z có chứa c gam muối. Biết các phản ứng xảy ra hoàn toàn 2b = a + c. Tỉ lệ x : y là
 Xem đáp án
Xem đáp án
Chọn D
Câu 39:
Đốt cháy hoàn toàn m gam một triglixerit X cần vừa đủ x mol O2, sau phản ứng thu được CO2 và y mol H2O. Biết m = 78x - 103y. Nếu cho a mol X tác dụng với dung dịch nước Br2 dư thì lượng Br2 phản tối đa là 0,15 mol. Giá trị của a là
 Xem đáp án
Xem đáp án
CnH2n+2-2kO6 + (1,5n – 0,5k – 2,5)O2 → nCO2 + (n + 1 – k)H2O
nO2 = x = a(1,5n – 0,5k – 2,5)
nH2O = y = a(n + 1 – k)
mX = m = a(14n + 98 – 2k)
→ 14n + 98 – 2k = 78(1,5n – 0,5k – 2,5) – 103(n + 1 – k)
→ k = 6
Có 3 nối đôi C=O trong este không phản ứng với Br2 nên nBr2 = 3nX → nX = 0,05
Câu 40:
Cho hình vẽ mô tả quá trình điều chế dung dịch X trong phòng thí nghiệm như sau:
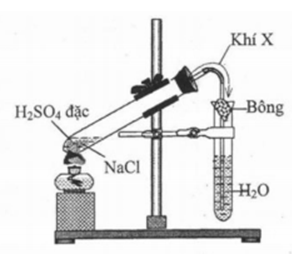
Trong điều kiện thích hợp dung dịch X có thể phản ứng với mấy chất trong số các chất sau: KMnO4, Na2CO3, Cu, Fe2O3, NaCl, Al(OH)3, NaHCO3?
 Xem đáp án
Xem đáp án
Khí X là khí HCl:
NaCl + H2SO4 → HCl + NaHSO4
Khí X tan trong nước tạo dung dịch HCl. Dung dịch X có các phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
