(2023) Đề thi thử Hóa học THPT Hai Bà Trưng, Thừa Thiên Huế (Lần 1) có đáp án
(2023) Đề thi thử Hóa học THPT Hai Bà Trưng, Thừa Thiên Huế (Lần 1) có đáp án
-
908 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Cho các kim loại: Ba, K, Fe, Cu, Ag, Na. Số kim loại được điều chế bằng phương pháp điện phân dung dịch muối của chúng là
 Xem đáp án
Xem đáp án
Các kim loại đứng sau Al có thể điều chế bằng phương pháp điện phân dung dịch muối của chúng → Chọn Fe, Cu, Ag.
Chọn D
Câu 4:
Để phân biệt các chất lỏng đựng trong các lọ riêng biệt: axit axetic, glixerol, triolein có thể chỉ cần dùng
 Xem đáp án
Xem đáp án
Để phân biệt các chất lỏng đựng trong các lọ riêng biệt: axit axetic, glixerol, triolein có thể chỉ cần dùng nước và quì tím:
+ Tan, làm quỳ tím hóa đỏ là axit axetic.
+ Tan, không làm đổi màu quỳ tím là glyxerol.
+ Không tan là triolein.
Chọn B
Câu 5:
Cho 1,17 gam hỗn hợp gồm Mg và Al tan hoàn toàn trong dung dịch H2SO4 loãng thu được 1,344 lít khí H2 và dung dịch chứa m gam muối sunfat trung hòa. Giá trị của m bằng
 Xem đáp án
Xem đáp án
nSO42-(muối) = nH2 = 0,06
→ m muối = m kim loại + mSO42- = 6,93 gam
Chọn D
Câu 6:
Hiđrat hóa 2-metylbut-2-en thu được sản phẩm chính là :
 Xem đáp án
Xem đáp án
2-metylbut-2-en là (CH3)2C=CH-CH3 khi cộng H2O theo quy tắc cộng Maccopnhicop thì nhóm OH sẽ gắn vào C bậc cao:
(CH3)2C=CH-CH3 + HOH → (CH3)2COH-CH2-CH3
→ Ancol là 2-metylbutan-2-ol.
Chọn C
Câu 7:
Cho 4,6 gam kim loại X tác dụng với nước dư, sau phản ứng hoàn toàn thu được dung dịch Y. Để trung hòa dung dịch Y cần vừa đủ dung dịch chứa 0,2 mol HCl. Kim loại X là
 Xem đáp án
Xem đáp án
Muối là XClx (0,2/x mol) → nX = 0,2/x mol
→ MX = 4,6x/0,2 = 23x
→ x = 1, MX = 23: X là Na
Chọn D
Câu 8:
Chất nào sau đây được sử dụng để đúc tượng, làm phấn, bó bột khi xương bị gãy?
 Xem đáp án
Xem đáp án
Chọn A
Câu 9:
Thực hiện phản ứng tráng bạc hoàn toàn m gam glucozơ thu được 86,4 gam Ag. Nếu lên men hoàn toàn m gam glucozơ rồi cho khí CO2 thu được hấp thụ vào nước vôi trong dư thì lượng kết thu được là
 Xem đáp án
Xem đáp án
2Ag ← C6H12O6 → 2CO2 → 2CaCO3
→ nCaCO3 = nAg = 0,8 → mCaCO3 = 80 gam
Chọn D
Câu 11:
Cho các chất sau đây: metan, etilen, but-1-in, axetilen, but-2-in. Số chất tham gia phản ứng với dung dịch AgNO3 trong NH3 là:
 Xem đáp án
Xem đáp án
Các hiđrocacbon có CH≡C- tham gia phản ứng với dung dịch AgNO3 trong NH3.
→ Có 2 chất trong dãy là but-1-in, axetilen.
Chọn B
Câu 13:
Trong các chất sau: axit glutamic, saccarozơ, metylamoni clorua, vinyl axetat, phenol, glixerol, Gly-Gly. Số chất tác dụng với dung dịch NaOH loãng, nóng là
 Xem đáp án
Xem đáp án
Các chất tác dụng với dung dịch NaOH loãng, nóng là: axit glutamic, metylamoni clorua, vinyl axetat, phenol, Gly-Gly
Chọn A
Câu 15:
Trong số các loại tơ sau: tơ nitron; tơ visco; tơ nilon-6,6; tơ lapsan; tơ axetat. Số tơ thuộc loại tơ nhân tạo (tơ bán tổng hợp) là
 Xem đáp án
Xem đáp án
Có 2 tơ: tơ visco; tơ axetat thuộc loại tơ nhân tạo (tơ bán tổng hợp).
Chọn B
Câu 17:
Cho các phát biểu sau:
(a) Hỗn hợp Cu, Fe3O4 có số mol bằng nhau tan hết trong lượng nước dư.
(b) Cho bột Cu vào lượng dư dung dịch FeCl3, thu được dung dịch chứa hai muối.
(c) Cho FeCl2 vào dung dịch hỗn hợp KMnO4 và H2SO4 (loãng) thấy có khí bay ra.
(d) Cho Mg tác dụng với lượng dư dung dịch FeCl3 thu được kim loại Fe.
(e) Đốt lá sắt trong khí Cl2 xảy ra sự ăn mòn điện hóa.
(g) Đun nóng có thể làm mềm nước có tính cứng vĩnh cửu.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, không tan trong H2O
(b) Sai, thu được dung dịch chứa 3 muối: CuCl2, FeCl2, FeCl3 dư
(c) Đúng:
Cl- + H+ + MnO4- → Cl2 + Mn2+ + H2O
Fe2+ + H+ + MnO4- → Fe3+ + Mn2+ + H2O
(d) Sai: Mg + FeCl3 dư → MgCl2 + FeCl2
(e) Sai, ăn mòn hóa học
(g) Sai, đun nóng chỉ làm mềm được nước cứng tạm thời.
Chọn C
Câu 19:
Trong thí nghiệm nào sau đây xảy ra ăn mòn điện hóa?
 Xem đáp án
Xem đáp án
A. Không có ăn mòn điện hóa do không có đủ 2 điện cực.
B. Không có ăn mòn điện hóa do không có môi trường điện li, thanh thép cũng đã được bảo vệ bề mặt bởi sơn.
C. Không có ăn mòn điện hóa do không có đủ 2 điện cực.
D. Có ăn mòn điện hóa do có đủ 2 điện cực (Fe và Cu, trong đó Cu tạo ra do Fe khử Cu2+), có môi trường điện li (dung dịch H2SO4) và chúng tiếp xúc nhau.
Chọn D
Câu 20:
Cho 15 gam glyxin tác dụng vừa đủ với 8,9 gam alanin thu được m gam hỗn hợp tripeptit mạch hở. Giá trị của m là
 Xem đáp án
Xem đáp án
nGly = 0,2; nAla = 0,1
3 Amino axit → Tripeptit + 2H2O
→ nH2O = 2nAmino axit / 3 = 0,2
→ mTripeptit = mAmino axit – mH2O = 20,3
Chọn A
Câu 22:
Có bao nhiêu tripeptit mạch hở khi thuỷ phân hoàn toàn đều thu được sản phẩm chỉ gồm alanin và glyxin?
 Xem đáp án
Xem đáp án
Các tripeptit khi thủy phân chỉ tạo Gly và Ala:
G-G-A; G-A-G, A-G-G
A-A-G, A-G-A, G-A-A
Chọn B
Câu 23:
Một mẫu nước cứng chứa các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
 Xem đáp án
Xem đáp án
Chất được dùng để làm mềm mẫu nước cứng trên là Na2CO3.
Ca2+ + CO32- → CaCO3
Mg2+ + CO32- → MgCO3
Chọn C
Câu 26:
Amin nào dưới đây có tính bazơ mạnh nhất?
 Xem đáp án
Xem đáp án
Gốc no làm tăng tính bazơ, gốc thơm làm giảm tính bazơ → C6H5CH2NH2 có tính bazơ mạnh nhất
Chọn B
Câu 30:
Peptit X bị thủy phân theo phương trình phản ứng X + 2H2O → 2Y + Z (trong đó Y và Z là các amino axit). Thủy phân hoàn toàn 4,06 gam X thu được m gam Z. Đốt cháy hoàn toàn m gam Z cần vừa đủ 1,68 lít khí O2 (đktc), thu được 2,64 gam CO2; 1,26 gam H2O và 224 ml khí N2 (đktc). Biết Z có công thức phân tử trùng với công thức đơn giản nhất. Tên gọi của Y là
 Xem đáp án
Xem đáp án
Trong m gam Z chứa:
nC = nCO2 = 0,06
nH = 2nH2O = 0,14
nN = 2nN2 = 0,02
nO = 2nCO2 + nH2O – 2nO2 = 0,04
→ C : H : N : O = 3 : 7 : 1 : 2
Vậy Z là C3H7NO2
→ nZ = nN = 0,02 → nX = 0,02
→ MX = 203
Phân tử X được tạo ra từ 2 phân tử Y và 1 phân tử Z nên:
MX = 2MY + 89 – 18.2 = 203
→ MY = 75 → Y là Gly.
Chọn A
Câu 31:
Este X được điều chế từ một ancol và một aminoaxit. Cho 36,05 gam X phản ứng hết với 300 ml dung dịch NaOH 1,5M, thu được dung dịch Y. Cô cạn dung dịch Y thu được ancol Z và m gam chất rắn. Biết X có khối lượng phân tử bằng 103 đvC và Z có khả năng tách nước tạo anken. Giá trị của m là
 Xem đáp án
Xem đáp án
MX = 103 → C4H9NO2
Z có khả năng tách nước tạo anken → X là H2N-CH2-COOC2H5; Z là C2H5OH
nX = 0,35; nNaOH = 0,45 → Chất rắn gồm GlyNa (0,35) và NaOH dư (0,1)
→ m rắn = 37,95 gam
Chọn D
Câu 32:
Đốt cháy hoàn toàn a gam triglixerit X cần vừa đủ 4,83 mol O2, thu được 3,42 mol CO2 và 3,18 mol H2O. Mặt khác, cho a gam X phản ứng vừa đủ với dung dịch NaOH, thu được b gam muối. Giá trị của b là
 Xem đáp án
Xem đáp án
Bảo toàn O: 6nX + 2nO2 = 2nCO2 + nH2O
→ nC3H5(OH)3 = nX = 0,06
Bảo toàn khối lượng: mX + mO2 = mCO2 + mH2O
→ mX = a = 53,16
Bảo toàn khối lượng cho phản ứng xà phòng hóa:
b = a + mNaOH – mC3H5(OH)3 = 54,84
Chọn C
Câu 33:
Dẫn luồng hơi nước qua than nóng đỏ thì thu được V lít (ở đktc) hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với H2 là 7,8. Toàn bộ V lít hợp khí X trên khử vừa đủ 24 gam hỗn hợp CuO, Fe2O3 nung nóng thu được rắn Y chỉ có 2 kim loại. Ngâm toàn bộ Y vào dung dịch HCl dư thấy có 4,48 lít H2 bay ra (ở đktc). Phần trăm thể tích khí CO2 trong X bằng
 Xem đáp án
Xem đáp án
nCuO = a và nFe2O3 = b
→ 80a + 160b = 24
nFe = 2b = nH2 = 0,2
→ a = b = 0,1
→ nO = a + 3b = 0,4
X chứa CO2 (x), CO (y) và H2 (z)
mX = 44x + 28y + 2z = 7,8.2(x + y + z)
nO = y + z = 0,4
Bảo toàn electron: 4x + 2y = 2z
→ x = 0,1; y = 0,1; z = 0,3
→ %VCO2 = 20%
Chọn B
Câu 34:
Cho các chất sau: (1) C2H5OH; (2) CH3CH3; (3) HCOOCH3; (4) CH3COOH. Sắp xếp các chất theo thứ tự tăng dần nhiệt độ sôi là:
 Xem đáp án
Xem đáp án
(1)(4) có liên kết H liên phân tử nên nhiệt độ sôi cao hơn (2)(3)
(3) có M lớn hơn (2) nên (3) sôi cao hơn (2)
(4) có M lớn hơn (1) và liên kết H liên phân tử bền hơn (1) nên (4) sôi cao hơn (1)
→ (2), (3), (1), (4).
Chọn D
Câu 35:
Đốt cháy hoàn toàn 6,8 gam hỗn hợp E gồm 2 este đơn chức, là đồng phân cấu tạo của nhau và đều chứa vòng benzen bằng một lượng O2 lấy dư, thu được 17,6 gam CO2 và 3,6 gam H2O. Đun nóng 6,8 gam E với dung dịch NaOH (dư) thì có tối đa 2,80 gam NaOH phản ứng, thu được dung dịch T chứa 8,28 gam hỗn hợp 3 muối. Khối lượng muối của axit cacboxylic có khối lượng phân tử lớn hơn trong T là
 Xem đáp án
Xem đáp án
nCO2 = 0,4; nH2O = 0,2 → nC = nH = 0,4
nO = (mE – mC – mH)/16 = 0,1
→ C : H : O = 4 : 4 : 1; E đơn chức nên E là C8H8O2.
nE = 0,05; nNaOH = 0,07
nE < nNaOH < 2nE nên E gồm este của ancol (0,03) và este của phenol (0,02)
→ nAncol = 0,03 và nH2O = 0,02
Bảo toàn khối lượng:
mE + mNaOH = m muối + mAncol + mH2O
→ mAncol = 0,96 → M ancol = 32: CH3OH
Sản phẩm có 3 muối nên E gồm C6H5COOCH3 (0,03) và CH3COOC6H5 (hoặc HCOOC6H4CH3)
Muối cacboxylat lớn nhất là C6H5COONa (4,32 gam)
Chọn B
Câu 36:
Phát biểu không đúng là:
 Xem đáp án
Xem đáp án
A. Sai:
CH3COOH + NaOH → CH3COONa + H2O
CH3COONa + CO2: Không phản ứng
B. Đúng:
C6H5OH + NaOH → C6H5ONa + H2O
C6H5ONa + HCl → C6H5OH + NaCl
C. Đúng:
C6H5NH2 + HCl → C6H5NH3Cl
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O
D. Đúng:
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
C6H5OH + NaOH → CH3COONa + H2O
Chọn A
Câu 37:
Tiến hành điện phân 400 ml dung dịch chứa CuSO4 xM và NaCl yM bằng điện cực trơ, màng ngăn xốp vói cường độ dòng điện không đổi I = 5A. Quá trình điện phân được ghi nhận theo bảng sau:.
|
Thời gian điện phân (giây) |
Khối lượng catot tăng (gam) |
Khí thoát ra ở hai cực |
Khối lượng dung dịch giảm (gam) |
|
t |
m |
Hai đơn chất khí |
a |
|
1,5t |
1,5m |
Hai đơn chất khí |
a + 5,6 |
|
2t |
1,5m |
Ba đơn chất khí |
2a - 7,64 |
Biết các khí sinh ra không tan trong dung dịch và hiệu suất quá trình điện phân đạt 100%. Giá trị của y và a lần lượt là
 Xem đáp án
Xem đáp án
nCuSO4 = 0,4x; nNaCl = 0,4y
Trong khoảng thời gian 0,5t giây (tính từ t đến 1,5t), catot thoát ra 0,5m gam Cu → Anot thoát nO2 = nCu/2 = m/256
→ m giảm = 0,5m + 32m/256 = 5,6
→ m = 8,96
→ nCuSO4 = 0,4x = 1,5m/64 → x = 0,525
ne trong t giây = 2m/64 = 0,28 = It/F → t = 5404
Tại thời điểm t giây:
Catot: nCu = 0,14
Anot: nCl2 = 0,2y, bảo toàn electron → nO2 = 0,07 – 0,1y
m giảm = 8,96 + 71.0,2y + 32(0,07 – 0,1y) = a (1)
Tại thời điểm 2t giây (ne = 0,56)
Catot: nCu = 0,21; nH2 = 0,07
Anot: nCl2 = 0,2y, bảo toàn electron → nO2 = 0,14 – 0,1y
m giảm = 0,21.64 + 0,07.2 + 71.0,2y + 32(0,14 – 0,1y) = 2a – 7,64 (2)
(1)(2) → y = 0,3; a = 14,5
Chọn C
Câu 38:
Cho sơ đồ phản ứng:
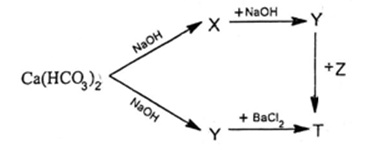
Biết T là hợp chất của kim loại kiềm thổ. Chất Z là chất nào dưới đây?
 Xem đáp án
Xem đáp án
Ca(HCO3)2 + NaOH → CaCO3 + NaHCO3 (X) + H2O
NaHCO3 + NaOH → Na2CO3 (Y) + H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 (Y) + 2H2O
Na2CO3 + BaCl2 → BaCO3 (T) + 2NaCl
Na2CO3 + Ba(NO3)2 (Z) → BaCO3 + 2NaNO3
Chất Z là Ba(NO3)2.
Chọn A
Câu 39:
Nung m gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3 và FeCO3 trong bình kín không có không khí, sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn Y và chất khí Z có tỷ khối so với H2 là 22,5 (giả sử NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch gồm 0,01 mol KNO3 và 0,15 mol H2SO4 (loãng) thu được dung dịch chỉ chứa 21,23 gam muối trung hòa của kim loại và hỗn hợp hai khí có tỷ khối so với H2 là 8, trong đó có một khí hóa nâu ngoài không khí. Phần trăm khối lượng của muối FeCO3 trong X gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
M khí = 16 → Khí gồm NO (0,01 mol ⇐ Bảo toàn N) và H2 (0,01 mol)
nH+ = 4nNO + 2nH2 + 2nO → nO = 0,12
Muối gồm K+ (0,01), SO42- (0,15) và Fe2+, Fe3+.
m muối = 21,23 → mFe = 6,44 gam
Vậy Y gồm Fe (6,44 gam) và O (0,12)
→ nZ = nNO2 + nCO2 = nO(Y) = 0,12
→ mZ = 0,12.2.22,5 = 5,4
Z gồm CO2 (0,06) và NO2 (0,06)
Bảo toàn khối lượng:
mX = mY + mZ = 13,76
nFeCO3 = nCO2 = 0,06 -® %FeCO3 = 50,58%
Chọn A
Câu 40:
Hỗn hợp X gồm K, K2O, Ba, BaO. Lấy m gam X hòa tan vào H2O dư thu được 0,21 mol H2 và dung dịch Y. Hấp thụ hết 0,54 mol CO2 vào Y thu được 11,82 gam kết tủa và dung dịch Z. Nhỏ từ từ dung dịch NaOH 1M vào Z đến khi kết tủa lớn nhất thì cần ít nhất 90 ml dung dịch NaOH 1M. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nBaCO3 = 0,06
Z chứa nBa(HCO3)2 = nNaOH = 0,09
Bảo toàn C → Z chứa nKHCO3 = 0,3
Bảo toàn K, Ba → X chứa K (0,3), Ba (0,15) và O
Bảo toàn electron: nK + 2nBa = 2nO + 2nH2
→ nO = 0,09
→ mX = 33,69
Chọn C
