(2023) Đề thi thử Hóa học THPT Trần Quốc Tuấn, Quảng Ngãi có đáp án
(2023) Đề thi thử Hóa học THPT Trần Quốc Tuấn, Quảng Ngãi có đáp án
-
862 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Phương pháp nào sau đây không thể làm mềm nước có tính cứng tạm thời?
 Xem đáp án
Xem đáp án
Nước cứng tạm thời có chứa Mg(HCO3)2, Ca(HCO3)2, gọi chung là M(HCO3)2:
A. M(HCO3)2 + Na2CO3 → MCO3 + NaHCO3
B. M(HCO3)2 + Ca(OH)2 → MCO3 + CaCO3 + H2O
C. M(HCO3)2 + HCl → MCl2 + CO2 + H2O
D. M(HCO3)2 → MCO3 + CO2 + H2O
Chọn C
Câu 2:
Nhôm bền trong trong không khí và nước do trên bề mặt của nhôm được phủ kín một lớp hợp chất rất mỏng nhưng rất bền, không cho nước và khí thấm qua. Hợp chất đó là :
 Xem đáp án
Xem đáp án
Chọn A
Câu 3:
Người hút thuốc lá có nguy cơ bị bệnh ung thư phổi rất cao. Chất gây nghiện và gây ung thư có trong thuốc lá là
 Xem đáp án
Xem đáp án
Chọn D
Câu 4:
Cho dung dịch Ca(HCO3)2 tác dụng với dung dịch nào sau đây có khí thoát ra?
 Xem đáp án
Xem đáp án
A. HCl + Ca(HCO3)2 → CaCl2 + CO2 + H2O
B. Na2CO3 + Ca(HCO3)2 → CaCO3 + NaHCO3
C. NaOH + Ca(HCO3)2 → CaCO3 + Na2CO3 + H2O
D. Ca(OH)2 + Ca(HCO3)2 → CaCO3 + H2O
Chọn A
Câu 6:
Khi để vôi sống trong không khí một thời gian có hiện tượng một phần vôi sống bị chuyển hóa trở lại thành đá vôi. Khí nào sau đây là tác nhân gây ra hiện tượng nêu trên?
 Xem đáp án
Xem đáp án
Khí cacbon đioxit là tác nhân gây ra hiện tượng nêu trên:
CaO + CO2 → CaCO3
Chọn D
Câu 8:
Phương pháp nào sau đây là phương pháp điện hóa, được sử dụng để chống ăn mòn kim loại?
 Xem đáp án
Xem đáp án
Phương pháp điện hóa dùng 1 kim loại có tính khử mạnh hơn kim loại cần được bảo vệ và gắn chúng vào nhau tại vị trí có môi trường điện li → Chọn B.
Câu 9:
Mùi tanh của cá (đặc biệt là cá mè) chủ yếu do hỗn hợp một số amin gây nên, trong đó có nhiều nhất là trimetylamin. Công thức cấu tạo thu gọn của trimetylamin là :
 Xem đáp án
Xem đáp án
Chọn C
Câu 10:
Từ tinh dầu hoa nhài tách được este X có công thức phân tử C9H10O2. Thủy phân X trong dung dịch NaOH, thu được natri axetat và một ancol thơm. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
C9H10O2 + NaOH → CH3COONa + Ancol thơm
→ Cấu tạo: CH3COOCH2C6H5
Chọn A
Câu 11:
Chất X thuộc loại monosaccarit, ở dạng cấu tạo mạch hở X có 5 nhóm -OH và 1 nhóm -CHO trong phân tử. Chất X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 14:
Quặng manhetit là quặng giàu sắt nhưng hiếm có trong tự nhiên. Thành phần chính của quặng manhetit là
 Xem đáp án
Xem đáp án
Chọn B
Câu 15:
Ngâm chiếc đinh sắt đã làm sạch lớp gỉ vào dung dịch CuSO4, sau một thời gian thấy
 Xem đáp án
Xem đáp án
Ngâm chiếc đinh sắt đã làm sạch lớp gỉ vào dung dịch CuSO4, sau một thời gian thấy màu xanh của dung dịch CuSO4 nhạt dần và trên đinh sắt có lớp đồng màu đỏ bám vào:
Fe + CuSO4 → FeSO4 + Cu
Chọn B
Câu 16:
Khi ăn các thực phẩm chứa chất béo, tinh bột hoặc protein thì phản ứng hóa học đầu tiên xảy ra trong cơ thể là phản ứng
 Xem đáp án
Xem đáp án
Chọn A
Câu 18:
Poli(vinyl clorua) là polime được ứng dụng nhiều trong công nghệ vật liệu, thường gọi là nhựa PVC. Công thức cấu tạo thu gọn của poli(vinyl clorua) là.
 Xem đáp án
Xem đáp án
Chọn B
Câu 19:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Đúng: HCOOC2H5 và CH3COOCH3
B. Sai, chỉ este có HCOO- tham gia phản ứng tráng bạc.
C. Sai, triolein (C17H33COO)3C3H5) là chất béo không no nên ở thể lỏng trong điều kiện thường.
D. Sai, tristearin (C17H35COO)3C3H5) là chất béo no nên không có phản ứng cộng với H2.
Chọn A
Câu 20:
Nước muối sinh li là dung dịch NaCl 0,9% (D = 1,0046 g/ml), được sử dụng để rửa vết thường, nhỏ mắt, rửa mũi, súc họng,… Để pha được 500 ml nước muối sinh lí thì khối lượng NaCl cần dùng là :
 Xem đáp án
Xem đáp án
mNaCl = 500.1,0046.0,9% ≈ 4,52 gam
Chọn D
Câu 21:
Trong y học, dược phẩm sữa magie (tinh thể Mg(OH)2 lơ lửng trong nước) được dùng để chữa chứng khó tiêu do dư HCl. Cứ 1,0 ml sữa magie chứa 0,08 gam Mg(OH)2. Để trung hòa 800,0 ml dung dịch HCl 0,03M trong dạ dày cần V ml sữa magie, giá trị của V là
 Xem đáp án
Xem đáp án
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
nHCl = 0,024 → nMg(OH)2 = 0,012
→ mMg(OH)2 = 0,696 gan
→ V = 0,696/0,08 = 8,7 ml
Chọn D
Câu 22:
Dầu chuối có thành phần chính là isoamyl axetat, thường dùng làm hương liệu cho thực phẩm. Một nhóm học sinh điều chế isoamyl axetat bằng cách đun 14,4 gam axit axetic với 15,84 gam ancol isoamylic có H2SO4 đặc xúc tác, hiệu suất phản ứng este hóa đạt 80% thu được m gam isoamyl axetat, giá trị của m là
 Xem đáp án
Xem đáp án
nCH3COOH = 0,24; n(CH3)2CHCH2CH2OH = 0,18
→ nCH3COOCH2CH2CH(CH3)2 = 0,18.80% = 0,144
→ mCH3COOCH2CH2CH(CH3)2 = 18,72 gam
Chọn B
Câu 23:
Cho các polime sau: polibutađien, poli(vinyl clorua), poli(etylen terephtalat), poli(hexametylen ađipamit), policaproamit. Số polime dùng để sản xuất tơ sợi là
 Xem đáp án
Xem đáp án
Có 3 polime dùng để sản xuất tơ sợi là poli(etylen terephtalat) (tơ lapsan), poli(hexametylen ađipamit) (tơ nilon-6,6), policaproamit (tơ nilon-6)
Chọn C
Câu 24:
Hình vẽ sau đây mô tả thí nghiệm phản ứng nhiệt nhôm xảy ra giữa Al và Fe2O3:
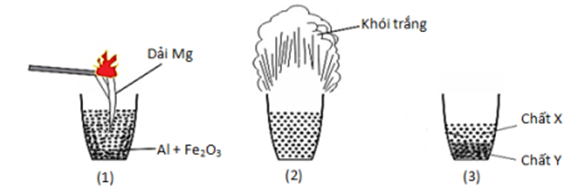
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Đúng, phản ứng nhiệt nhôm không tự xảy ra ở điều kiện thường nên cần đốt dải Mg để khơi mào nhiệt cho phản ứng nhiệt nhôm.
B. Đúng, phản ứng nhiệt nhôm tạo ra sắt dạng nóng chảy nên được ứng dụng để hàn đường ray.
C. Đúng, sắt nóng chảy nặng hơn Al2O3 nóng chảy nên chìm phía dưới.
D. Sai, khói trắng là các tinh thể Al2O3.
Chọn D
Câu 25:
Dẫn khí CO qua ống sứ đựng 8,04 gam hỗn hợp X gồm các oxit sắt, nung nóng, thu được hỗn hợp khí Y và m gam chất rắn. Dẫn hỗn hợp Y vào dung dịch Ca(OH)2 dư, thu được 13,5 gam kết tủa. Giá trị của m là ?
 Xem đáp án
Xem đáp án
Ca(OH)2 dư → nCO2 = nCaCO3 = 0,135
→ nO bị lấy = 0,135
→ m rắn = mX – mO = 5,88 gam
Chọn C
Câu 26:
Dung dịch X chứa các ion: Na+ (x mol), NH4+ (2x mol), CO32- (0,05 mol) và HCO3- (0,02 mol). Tổng khối lượng chất tan trong dung dịch X là
 Xem đáp án
Xem đáp án
Bảo toàn điện tích: x + 2x = 0,05.2 + 0,02 → x = 0,04
→ m chất tan = 23x + 18.2x + 0,05.60 + 0,02.61 = 6,58 gam
Chọn C
Câu 27:
Hỗn hợp X gồm glyxin, alanin và axit glutamic, trong đó nguyên tố oxi chiếm 32% về khối lượng. Cho m gam X tác dụng với lượng vừa đủ dung dịch hỗn hợp gồm NaOH 1M và KOH 1M, thu được 7,8 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nNaOH = nKOH = x → nO(X) = 4x và nH2O = 2x
Bảo toàn khối lượng:
4x.16/32% + 40x + 56x = 7,8 + 18.2x → x = 0,03
→ m = 4x.16/32% = 6 gam
Chọn B
Câu 28:
Hấp thụ hết 1,68 lít (đktc) khí CO2 vào 200 ml dung dịch hỗn hợp gồm NaOH 0,25M và Na2CO3 0,4M, thu được dung dịch X. Cho dung dịch X tác dụng với dung dịch BaCl2 dư, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
nCO2 = 0,075; nNaOH = 0,05; nNa2CO3 = 0,08
nNa/nC = (0,05 + 0,08.2)/(0,075 + 0,08) = 1,355
→ X chứa Na2CO3 (0,055) và NaHCO3 (0,1)
→ nBaCO3 = nNa2CO3 = 0,055 → m = 10,835 gam
Chọn C
Câu 29:
Tiến hành thí nghiệm như sau:
Bước 1: Cho 3 ml dung dịch AgNO3 2% vào hai ống nghiệm (1) và (2) sau đó cho dung dịch NH3 3% vào cho đến khi kết tủa tan hết và dung dịch NH3 dư.
Bước 2: Cho 2 ml dung dịch saccarozơ 5% và 0,5 ml dung dịch H2SO4 loãng vào ống nghiệm (3) rồi đun nóng nhẹ trong khoảng 3 phút sau đó để nguội.
Bước 3: Cho từ từ NaHCO3 vào ống nghiệm (3) và khuấy cho đến khi hết khí CO2 thoát ra.
Bước 4: Cho 2 ml dung dịch saccarozơ 5% vào ống nghiệm (1) rồi đặt vào cốc nước nóng (khoảng 60°C), sau vài phút lấy ra.
Bước 5: Cho dung dịch trong ống nghiệm (3) vào ống nghiệm (2) rồi đặt vào cốc nước nóng (khoảng 60°C), sau vài phút lấy ra.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Đúng, saccarozơ + H2O → Glucozơ + Fructozơ
B. Đúng, phản ứng tráng gương thực hiện trong môi trường kiềm nên cần loại bỏ axit trước khi tiến hành:
NaHCO3 + H2SO4 → Na2SO4 + CO2 + H2O
C. Đúng, sau bước 1 tạo phức bạc nhưng để đơn giản vẫn ghi là dung dịch AgNO3 trong NH3.
D. Sai, sau bước 5 có lớp bạc sáng bám vào thành ống nghiệm.
Chọn D
Câu 30:
X, Y, Z, T thuộc loại cacbohiđrat. X có nhiều trong quả nho chín, Y có trong cây mía, Z có trong hạt gạo, T có nhiều trong bông nõn. Cho các phát biểu sau:
(a) X, Y, Z, T đều có phản ứng thủy phân.
(b) X, Y tan nhiều trong nước, vị ngọt.
(c) X, Z đều có phản ứng tráng bạc.
(d) Z, T thuộc loại polisaccarit.
(e) Hiđro hóa X thu được axit gluconic.
Số phát biểu đúng là :
 Xem đáp án
Xem đáp án
X có nhiều trong quả nho chín → X là glucozơ
Y có trong cây mía → Y là saccarozơ
Z có trong hạt gạo → Z là tinh bột
T có nhiều trong bông nõn → T là xenlulozơ
(a) Sai, X là monosaccarit nên không bị thủy phân, Y, Z, T đều có phản ứng thủy phân.
(b) Đúng
(c) Sai, X có tráng bạc, Z không tráng bạc.
(d) Đúng, Z, T có dạng (C6H10O5)n
(e) Sai, hiđro hóa X thu được sobitol.
Chọn A
Câu 31:
Có bốn dung dịch mất nhãn X, Y, Z, T, mỗi dung dịch chứa một chất tan trong các chất: HCl, H2SO4, Na2CO3, NaHCO3. Tiến hành thí nghiệm cho kết quả sau:
|
Dung dịch thuốc thử |
Dung dịch mất nhãn |
|||
|
X |
Y |
Z |
T |
|
|
HCl |
↑ |
↑ |
- |
- |
|
BaCl2 |
- |
↓ trắng |
- |
↓ trắng |
|
Na2CO3 |
- |
- |
↑ |
↑ |
(a) Chất tan trong dung dịch Y là Na2CO3.
(b) Chất tan trong dung dịch X thuộc loại hợp chất lưỡng tính.
(c) Dung dịch Z và dung dịch T làm đỏ quì tím.
(d) Dung dịch Z tạo kết tủa với dung dịch AgNO3.
(e) Chất tan trong dung dịch X không bị nhiệt phân.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
X tạo khí với HCl, không phản ứng với BaCl2 → X là NaHCO3
Y tạo khí với HCl, tạo kết tủa với BaCl2 → Y là Na2CO3
Z không phản ứng với BaCl2, tạo khí với Na2CO3 → Z là HCl.
Còn lại T là H2SO4.
(a)(b)(c) Đúng
(d) Đúng: HCl + AgNO3 → AgCl + HNO3
(e) Sai: NaHCO3 (t°) → Na2CO3 + CO2 + H2O
Chọn B
Câu 32:
Một trong các phương pháp dùng để loại bỏ sắt trong nguồn nước nhiễm sắt là sử dụng lượng vôi tôi vừa đủ để tăng pH của nước nhằm kết tủa ion sắt khi có mặt oxi, theo sơ đồ phản ứng
(1) Fe3+ + OH- → Fe(OH)3
(2) Fe2+ + OH- + O2 + H2O → Fe(OH)3
Một mẫu nước có hàm lượng sắt cao gấp 28 lần so với ngưỡng cho phép là 0,30 mg/l (theo QCVN 01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+ : Fe2+ = 1 : 4. Cần tối thiểu m gam Ca(OH)2 để kết tủa hoàn toàn lượng sắt trong 10 m³ mẫu nước trên. Giá trị của m là
 Xem đáp án
Xem đáp án
(1) Fe3+ + 3OH- → Fe(OH)3
(2) 4Fe2+ + 8OH- + O2 + 2H2O → 4Fe(OH)3
nFe3+ + nFe2+ = (0,3.28.10)/56 = 1,5 mol
Fe3+ : Fe2+ = 1 : 4 → nFe3+ = 0,3 và nFe2+ = 1,2
→ nOH- = 3nFe3+ + 2nFe2+ = 3,3
→ nCa(OH)2 = 1,65 → mCa(OH)2 = 122,1 gam
Chọn D
Câu 33:
Từ m kg gạo chứa 78% tinh bột, bằng phương pháp lên men, điều chế được V ml dung dịch ancol etylic 92°, hiệu suất quá trình đạt 100%. Từ V ml dung dịch ancol etylic 92° nói trên pha chế được 4,485 lít nước rửa tay sát khuẩn (chứa 80% ancol etylic về thể tích) để sử dụng trong phòng dịch Covid - 19. Biết khối lượng riêng của ancol etylic là 0,8 gam/ml. Giá trị V và m lần lượt là
 Xem đáp án
Xem đáp án
VC2H5OH = 4,485.80% = 3,588
→ VC2H5OH 92° = 3,588/92% = 3,9 lít = 3900 ml
nC2H5OH = 3,588.0,8/46 = 0,0624 kmol
→ m gạo = 0,0624.162/(2.78%) = 6,48 kg
Chọn B
Câu 34:
Một khu vườn trồng 500 cây ăn quả đang trong giai đoạn ra hoa và kết trái. Để cung cấp đủ nguyên tố dinh dưỡng N, P, K người ta đã bón 75 kg phân NPK (15-5-25), 25 kg phân urê (46% N) và 25 kg phân kali (60% K2O). Trung bình cứ mỗi cây ăn quả nói trên cần x gam N, y gam P và z gam K. Tổng (x + y + z) có giá trị gần với
 Xem đáp án
Xem đáp án
mN = 500x = 10³(75.15% + 25.46%) → x = 45,5 gam
mP = 500y = 10³(31.2.5%.75/142) → y = 3,3 gam
mK = 500z = 10³(39.2.25%.75/94 + 39.2.60%.25/94)
→ z = 56 gam
→ x + y + z = 104,8 gam
Chọn C
Câu 35:
Chất béo X chứa các triglixerit và x mol axit béo tự do, trong X cacbon chiếm 77,4% khối lượng. Xà phòng hóa hoàn toàn m gam X bằng dung dịch NaOH vừa đủ, thu được 4,048 gam glixerol và 41,32 gam hỗn hợp muối C17H35COONa, C17H33COONa, C17H31COONa. Mặt khác, m gam X phản ứng tối đa với y mol Br2 trong dung dịch. Giá trị của x và y lần lượt là
 Xem đáp án
Xem đáp án
Các muối đều 18C nên triglixerit có 57C.
nTriglixerit = nC3H5(OH)3 = 0,044
→ nNaOH = x + 0,132
Bảo toàn khối lượng:
12(0,044.57 + 18x)/77,4% + 40(x + 0,132) = 4,048 + 41,32 + 18x
→ x = 0,004
Quy đổi X thành C17H35COONa (x + 0,132 = 0,136) và H2 (-y)
m muối = 0,136.306 – 2y = 41,32 → y = 0,148
Chọn A
Câu 36:
Khí biogas là loại khí sinh học, thành phần chính gồm metan chiếm 60% thể tích, còn lại là cacbon đioxit và các khí khác. Muốn nâng nhiệt độ 1 gam nước lên 1°C cần cung cấp nhiệt lượng là 4,18 J và phản ứng đốt cháy 1 mol metan tỏa ra nhiệt lượng là 890 kJ. Biết khối lượng riêng của nước là 1 g/ml và hiệu suất sử dụng nhiệt để đun nóng nước là 70%. Thể tích khí biogas (đktc) tối thiểu cần dùng để đun 1780 ml nước từ 25°C lên 100°C là
 Xem đáp án
Xem đáp án
nCH4 = x, bảo toàn năng lượng:
70%.890.10³.x = 1780.4,18(100 – 25) → x = 0,896 mol
→ V biogas = 0,896.22,4/60% = 33,45 lít
Chọn C
Câu 37:
Nung nóng m gam hỗn hợp X gồm FeCO3, CuO, FeS2 trong bình kín thể tích không đổi chứa 0,25 mol O2 (lấy dư) cho đến khi phản ứng xảy ra hoàn toàn rồi đưa về nhiệt độ ban đầu thấy áp suất khí trong bình giảm 6% so với áp suất ban đầu, đồng thời thu được (m - 2,32) gam hỗn hợp rắn Y. Mặt khác, hòa tan hết m gam hỗn hợp X bằng lượng vừa đủ dung dịch H2SO4 80%, đun nóng, thu được hỗn hợp khí Z gồm CO2, SO2 và dung dịch T chứa (m + 8,08) gam hỗn hợp muối Fe2(SO4)3, CuSO4. Nồng độ phần trăm của Fe2(SO4)3 trong dung dịch T là
 Xem đáp án
Xem đáp án
Đặt a, b, c là số mol FeS2, FeCO3, CuO
→ 120a + 116b + 80c = m (1)
→ nO2 phản ứng = 2,75a + 0,25b; nSO2 = 2a; nCO2 = b
Áp suất giảm 6% nên số mol khí cũng giảm 6%
→ 2a + b – (2,75a + 0,25b) = -6%.0,25 (2)
Y gồm Fe2O3 (0,5a + 0,5b) và CuO (c)
→ mY = 160(0,5a + 0,5b) + 80c = m – 2,32 (3)
T chứa Fe2(SO4)3 (0,5a + 0,5b) và CuSO4 (c)
→ 400(0,5a + 0,5b) + 160c = m + 8,08 (4)
(1)(2)(3)(4) → a = 0,04; b = 0,02; c = 0,04; m = 10,32
Bảo toàn electron → nSO2 = (15a + b)/2 = 0,31
Bảo toàn S → nH2SO4 = 0,36
mddT = m + mddH2SO4 – mSO2 – mCO2 = 33,7
→ C%Fe2(SO4)3 = 35,61%
Chọn A
Câu 38:
Điện phân dung dịch chứa NaCl và CuSO4 (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi, hiệu suất điện phân 100%, bỏ qua sự hoà tan của khí trong nước và sự bay hơi của nước) trong thời gian t giây, khối lượng catot tăng m1 gam, khối lượng dung dịch giảm m2 gam. Kết quả thí nghiệm được ghi ở bảng sau:
|
t (giây) |
m1 (gam) |
m2 (gam) |
Khí thoát ra ở anot |
|
1200 |
a |
4,050 |
Một khí |
|
3600 |
3a |
11,325 |
Hỗn hợp khí |
|
t1 |
3,75a |
13,800 |
Hỗn hợp khí |
Giá trị của t1 là
 Xem đáp án
Xem đáp án
Lúc 1200s: nCu = nCl2 = 4,05/135 = 0,03
Lúc 3600s: nCu = 0,09; nCl2 = u và nO2 = v
→ 2u + 4v = 0,09.2 và 71u + 32v + 0,09.64 = 11,325
→ u = 0,075; v = 0,0075
Lúc t1: nCu = 0,03.3,75 = 0,1125; nH2 = x; nCl2 = 0,075 và nO2 = y
→ 0,1125.2 + 2x = 0,075.2 + 4y
m giảm = 0,1125.64 + 2x + 0,075.71 + 32y = 13,8
→ x = y = 0,0375
ne lúc t1 = 0,1125.2 + 2x = 0,3
ne lúc 1200 = 0,06
→ t1 = 1200.0,3/0,06 = 6000s
Chọn A
Câu 39:
Hỗn hợp E gồm este X (x gam) đơn chức và este Y (y gam) hai chức mạch hở. Cho m gam hỗn hợp E tác dụng vừa đủ với 210 ml dung dịch NaOH 1M, thu được một ancol Z và 20,73 gam hỗn hợp M gồm hai muối. Đốt cháy hoàn toàn hỗn hợp M thu được Na2CO3 và 1,02 mol hỗn hợp khí gồm CO2, hơi H2O. Cho ancol Z vào bình đựng Na dư, sau phản ứng có 1,344 lít (đktc) H2 thoát ra và khối lượng bình tăng 4,44 gam. Khối lượng của X và Y trong hỗn hợp E lần lượt là
 Xem đáp án
Xem đáp án
nH2 = 0,06 → nOH(Z) = 0,12 < nNaOH = 0,21 nên X là este của phenol
M gồm hai muối → Z dạng R(OH)2 (0,06 mol)
m bình tăng = 0,06(R + 32) = 4,44 → R = 42
→ Z là C3H6(OH)2
Y là (ACOO)2C3H6 (0,06); X là ACOOP (0,045)
Muối gồm ACOONa (0,165) và PONa (0,045)
m muối = 0,165(A + 67) + 0,045(P + 39) = 20,73
→ 11A + 3P = 528
→ A = 27; P = 77 là nghiệm duy nhất.
X là C2H3COOC6H5 (0,045) → mX = 6,66
Y là (C2H3COO)2C3H6 (0,06) → mY = 11,04
Chọn A
Câu 40:
Cho sơ đồ phản ứng sau:
(1) E (C9H8O4) + 2NaOH (t°) → X + Y + 2H2O.
(2) X + 2NaOH (CaO, t°) → CH4 + 2Na2CO3
(3) Y + CO2 + H2O → Z + NaHCO3.
Cho các phát biểu sau:
(a) E là hợp chất tạp chức.
(b) X là muối natri của axit hai chức.
(c) Y là muối có khối lượng mol phân tử là 114 gam/mol.
(d) Dung dịch Z làm quì tím hóa đỏ.
(e) Z có phản ứng với dung dịch NaOH.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(2) → X là CH2(COONa)2
(1) → Y có 6C
(3) → Y là C6H5ONa và Z là C6H5OH
E là HOOC-CH2-COOC6H5
(a) Đúng, E chứa chức este và axit.
(b) Đúng, X là muối cacboxylat 2 chức.
(c) Sai, MY = 116
(d) Sai, dung dịch Z có tính axit nhưng rất yếu, không làm đổi màu quỳ tím.
(e) Đúng: C6H5OH + NaOH → C6H5ONa + H2O
Chọn D
