(2023) Đề thi thử Hóa THPT Kiến An, Hải Phòng (Lần 2) có đáp án
(2023) Đề thi thử Hóa THPT Kiến An, Hải Phòng (Lần 2) có đáp án
-
1076 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 4:
Cho thanh kim loại Zn vào dung dịch chất nào sau đây chỉ xảy ra hiện tượng ăn mòn hóa học?
 Xem đáp án
Xem đáp án
Chọn B
Câu 5:
Nước cứng vĩnh cửu tác dụng với chất nào sau đây thu được kết tủa?
 Xem đáp án
Xem đáp án
Nước cứng vĩnh cửu (chứa Mg2+, Ca2+, Cl-, SO42-) tác dụng với Na2CO3 thu được kết tủa:
Mg2+ + CO32- —> MgCO3
Ca2+ + CO32- —> CaCO3
Chọn B
Câu 6:
Trong điều kiện không có oxi, hợp chất nào sau đây tác dụng với lượng dư dung dịch H2SO4 đặc, nóng có khí thoát ra?
 Xem đáp án
Xem đáp án
Hợp chất Fe3O4 tác dụng với lượng dư dung dịch H2SO4 đặc, nóng có khí SO2 thoát ra:
2Fe3O4 + 10H2SO4 đặc nóng → 3Fe2(SO4)3 + SO2 + 10H2O
Chọn A
Câu 7:
Trong phản ứng của kim loại Al với khí Cl2, một nguyên tử Al nhường bao nhiêu electron?
 Xem đáp án
Xem đáp án
Một nguyên tử Al nhường 3 electron:
Al → Al+3 + 3e
Chọn B
Câu 13:
Trong y học, muối nào sau đây được dùng để sản xuất thuốc giảm đau dạ dày do thừa axit?
 Xem đáp án
Xem đáp án
Chọn A
Câu 16:
Ancol nào sau đây trong phân tử có số nhóm -OH bằng với số nguyên tử cacbon?
 Xem đáp án
Xem đáp án
Chọn B
Câu 18:
Trong công nghiệp, thạch cao nung được sử dụng để đúc tượng, làm phấn viết bảng. Trong y học được sử dụng để bó bột khi gãy xương. Thành phần chính của thạch cao nung là
 Xem đáp án
Xem đáp án
Chọn C
Câu 20:
Chất nào sau đây khi thủy phân hoàn toàn trong môi trường axit, thu được hai hợp chất hữu cơ khác nhau đều có phản ứng tráng gương?
 Xem đáp án
Xem đáp án
Saccarozơ + H2O → Glucozơ + Fructozơ
Các sản phẩm glucozơ, fructozơ đều có phản ứng tráng gương.
Chọn A
Câu 21:
Hòa tan hết 8,9 gam hỗn hợp gồm Mg và Zn cần vừa đủ 400 ml dung dịch HCl 1M, sau phản ứng thu được dung dịch chứa m gam hỗn hợp muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nCl-(muối) = nHCl = 0,4
—> m muối = 8,9 + 0,4.35,5 = 23,10 gam
Chọn A
Câu 22:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
D sai, trùng hợp buta-1,3-đien thu được polime dùng để sản xuất cao su.
Chọn D
Câu 23:
Thí nghiệm nào sau đây không xảy ra phản ứng?
 Xem đáp án
Xem đáp án
A. KOH + KHCO3 —> K2CO3 + H2O
B. (NH4)2SO4 + BaCl2 —> BaSO4 + 2NH4Cl
C. Không phản ứng.
D. Al + 4HNO3 —> Al(NO3)3 + NO + 2H2O
Chọn C
Câu 24:
Cho dung dịch chứa m gam glucozơ tác dụng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 10,8 gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
nAg = 0,1 —> nGlucozơ = 0,05
—> mGlucozơ = 0,05.180 = 9 gam
Chọn D
Câu 25:
Cho 13,50 gam một amin mạch hở, đơn chức X tác dụng hết với dung dịch HCl, thu được 24,45 gam muối. Số nguyên tử cacbon trong amin X trên là
 Xem đáp án
Xem đáp án
nX = nHCl = (24,45 – 13,5)/36,5 = 0,3
—> MX = 45: C2H7N
Chọn A
Câu 26:
Tinh thể chất rắn X không màu, vị ngọt, dễ tan trong nước. X có nhiều trong cây mía, củ cải đường và hoa thốt nốt. Trong công nghiệp, X được chuyển hóa thành chất Y dùng để tráng gương, tráng ruột phích. Tên gọi của X và Y lần lượt là
 Xem đáp án
Xem đáp án
X có nhiều trong cây mía, củ cải đường và hoa thốt nốt —> X là saccarozơ.
Từ X được chuyển hóa thành chất Y dùng để tráng gương, tráng ruột phích —> Y là glucozơ.
Chọn D
Câu 27:
Hòa tan hoàn toàn 2,16 gam kim loại M vào dung dịch HCl, thu được 2,016 lít H2 (đktc). Kim loại M là:
 Xem đáp án
Xem đáp án
nH2 = 0,09, kim loại M hóa trị x, bảo toàn electron:
2,16x/M = 0,09.2 —> M = 12x
—> x = 2, M = 24: M là Mg
Chọn C
Câu 28:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
D sai, phân tử CH2=C(CH3)COOCH3 có 2 liên kết π, gồm 1C=C và 1C=O
Chọn D
Câu 29:
Cho bột kim loại Cu dư vào dung dịch gồm Fe(NO3)3, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch chứa muối nào sau đây?
 Xem đáp án
Xem đáp án
Cu + Fe(NO3)3 —> Cu(NO3)2 + Fe(NO3)2
Cu dư nên Fe(NO3)3 hết, dung dịch thu được chứa 2 muối Cu(NO3)2, Fe(NO3)2.
Chọn A
Câu 30:
Đốt cháy hoàn toàn 0,05 mol este X thu được 3,36 lít khí CO2 (ở đktc) và 2,7 gam H2O. Số đồng phân cấu tạo của X là
 Xem đáp án
Xem đáp án
nCO2 = nH2O = 0,15 nên X là este no, đơn chức, mạch hở.
Số C = nCO2/nX = 3 —> X là C3H6O2
Cấu tạo: HCOOCH2CH3; CH3COOCH3
Chọn D
Câu 31:
Cho các phát biểu sau:
(a) Xenlulozơ là nguyên liệu chế tạo thuốc súng không khói và sản xuất tơ nhân tạo.
(b) Cồn khô (cồn sáp) dùng để nấu lẩu, nướng mực có thành phần chính là metanol.
(c) Để giữ độ bền cho các loại vải làm từ tơ tằm, người ta thường ngâm giặt chúng trong nước xà phòng có tính kiềm cao.
(d) 1 mol đipeptit (Gly-Glu) phản ứng được tối đa với 2 mol NaOH trong dung dịch.
(e) Tơ nilon-6,6 được điều chế từ phản ứng trùng ngưng hexametylenđiamin và axit terephtalic.
Số phát biểu không đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Sai, cồn khô có thành phần chính là etanol.
(c) Sai, tơ tằm bị thủy phân trong kiềm nên không giặt chúng trong nước xà phòng có tính kiềm cao.
(d) Sai: Gly-Glu + 3NaOH —> GlyNa + GluNa2 + 2H2O
(e) Sai, trùng ngưng hexametylenđiamin và axit adipic.
Chọn B
Câu 32:
Thực hiện các thí nghiệm sau:
(a) Cho kim loại K vào dung dịch Fe2(SO4)3.
(b) Cho kim loại Al2O3 vào dung dịch NaOH dư.
(c) Cho dung dịch Ba(OH)2 vào dung dịch NaHCO3.
(d) Cho (NH4)2SO4 vào dung dịch Ba(OH)2 đun nóng.
(e) Cho chất rắn BaCO3 vào dung dịch H2SO4.
Sau khi các phản ứng kết thúc, số thí nghiệm vừa thu được kết tủa vừa thu được chất khí là
 Xem đáp án
Xem đáp án
(a) K + H2O —> KOH + H2
KOH + Fe2(SO4)3 —> Fe(OH)3 + K2SO4
(b) Al2O3 + NaOH —> NaAlO2 + H2O
(c) Ba(OH)2 + NaHCO3 —> BaCO3 + NaOH + H2O
(d) (NH4)2SO4 + Ba(OH)2 —> BaSO4 + NH3 + H2O
(e) BaCO3 + H2SO4 —> BaSO4 + CO2 + H2O
Chọn B
Câu 33:
Sau mùa thu hoạch, người nông dân cần phải bón phân cung cấp dinh dưỡng cho đất gồm 60,08 kg nitơ, 23,13 kg phot pho và 12,48 kg kali. Sau khi đã bón cho mảnh vườn 188 kg loại phân bón trên bao bì có ghi NPK (16-16-8) thì để cung cấp dinh dưỡng cho đất người nông dân tiếp tục bón thêm cho đất đồng thời x kg phân đạm chứa 98,5% (NH2)2CO (thành phần còn lại là các tạp chất không chứa nitơ) và y kg supephotphat kép chứa 69,62% Ca(H2PO4)2 (thành phần còn lại là các tạp chất không chứa photpho). Giá trị của (x + y) gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
mN = 60,08 = 188.16% + 98,5%x.28/60 —> x = 65,265
mP = 23,13 = 188.16%.31.2/142 + 69,62%y.31.2/234
—> y = 54,192
—> x + y = 119,457
Chọn D
Câu 34:
Cho các dung dịch: HCl, NaHCO3, Al2(SO4)3, KNO3, NH4Cl. Số lượng chất trong dung dịch có thể tác dụng được với dung dịch Ba(OH)2 là
 Xem đáp án
Xem đáp án
Các chất trong dung dịch có thể tác dụng được với dung dịch Ba(OH)2 là: HCl, NaHCO3, Al2(SO4)3, NH4Cl.
HCl + Ba(OH)2 → BaCl2 + H2O
NaHCO3 + Ba(OH)2 → BaCO3 + NaOH + H2O
Al2(SO4)3 + Ba(OH)2 → BaSO4 + Al(OH)3
NH4Cl + Ba(OH)2 → BaCl2 + NH3 + H2O
Chọn B
Câu 35:
Bình “ga” sử dụng trong hộ gia đình Y có chứa 10,92 kg khí hóa lỏng (LPG) gồm propan và butan với tỉ lệ mol tương ứng là 3 : 4. Khi được đốt cháy hoàn toàn, 1 mol propan tỏa ra lượng nhiệt là 2220 kJ và 1 mol butan tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ' đốt khí “ga” của hộ gia đình Y tương ứng với bao nhiêu số điện? (Biết hiệu suất sử dụng nhiệt là 50% và 1 số điện = 1 kWh = 3600 kJ)
 Xem đáp án
Xem đáp án
nC3H8 = 3x; nC4H10 = 4x
—> 44.3x + 58.4x = 10,92.1000 —> x = 30
Nhiệt lượng có ích = 50%(2220.3x + 2850.4x) = 270900 kJ
Số điện tương ứng = 270900/3600 = 75,25 số
Chọn C
Câu 36:
Hoà tan hoàn toàn 53,80 gam hỗn hợp X gồm Fe, Fe(OH)2, Fe2O3, CuO trong 216 gam dung dịch HNO3 70% được 10,08 lít hỗn hợp khí gồm NO và NO2 có tổng khối lượng là 17,5 gam, dung dịch Y [chỉ chứa muối của ion kim loại, trong đó nồng độ phần trăm của Fe(NO3)3 là 43,163%]. Cô cạn cẩn thận Y thu được hỗn hợp muối khan Z. Nung Z đến khối lượng không đổi được chất rắn T và hỗn hợp khí E có tỷ lệ mol là 13 : 3. Thành phần phần trăm khối lượng của Fe(OH)2 trong X có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
mddY = mX + mddHNO3 – m khí = 252,3
—> nFe(NO3)3 = 252,3.43,163%/242 = 0,45
Y chứa Fe(NO3)3 (0,45), Fe(NO3)2 và Cu(NO3)2
E gồm nNO2 = 2,4 – n khí = 1,95 —> nO2 = 0,45
Bảo toàn electron —> nFe(NO3)2 = 4(1,95/4 – 0,45) = 0,15
Bảo toàn N —> nCu(NO3)2 = 0,15
X gồm Fe (a), Fe(OH)2 (b), Fe2O3 (c) và CuO (0,15)
mX = 56a + 90b + 160c + 0,15.80 = 53,8
Bảo toàn Fe —> a + b + 2c = 0,45 + 0,15
nHNO3 = 2,4; nNO = 0,2; nNO2 = 0,25
nH+ = 2,4 = 0,2.4 + 0,25.2 + 2b + 2.3c + 0,15.2
—> a = 0,3; b = 0,1; c = 0,1
—> %Fe(OH)2 = 16,73%
Chọn B
Câu 37:
Hỗn hợp E gồm ba este không có khả năng thực hiện phản ứng tráng bạc X, Y, Z (X, Y mạch hở có cùng số nhóm chức; Z đơn chức và πZ = πY = πX + 1). Thuỷ phân hoàn toàn 0,44 mol E cần vừa đủ 440 ml dung dịch NaOH 2M thu được dung dịch chứa hỗn hợp muối F và các ancol no, đơn chức. Đốt cháy hoàn toàn 0,44 mol E cần dùng 3,28 mol khí O2 thu được H2O và 136,84 gam CO2. Mặt khác, 0,44 mol E tác dụng với tới đa 200 ml dung dịch Br2 2M. Trong E este có số mol nhỏ nhất chiếm phần trăm về khối lượng có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nCO2 = 3,11; nNaOH = 0,88
Nếu E không chứa este của phenol thì nO(E) = 0,88.2 = 1,76
Bảo toàn O —> nH2O = 2,1
(nCO2 – nH2O) = (k – 1).nE —> k = 145/44
—> nBr2 = 0,44(k – nNaOH/nE) = 0,57 ≠ 0,4: Vô lý
Vậy Z là este của phenol —> Z phản ứng với NaOH theo tỉ lệ mol 1 : 2
Dễ thất nE : nNaOH = 1 : 2 —> X, Y cũng phản ứng với NaOH theo tỉ lệ mol 1 : 2, mặt khác X, Y cùng chức nên X, Y đều 2 chức.
Quy đổi E thành (COOCH3)2 (a), CH3COOC6H5 (b), CH2 (c) và H2 (-0,4)
nE = a + b = 0,44
nO2 = 3,5a + 9b + 1,5c – 0,4.0,5 = 3,28
nCO2 = 4a + 8b + c = 3,11
—> a = 0,27; b = 0,17; c = 0,67
—> mE = 63,56
X có độ không no là k —> Độ không no của Z = của Y = k + 1
Z chứa vòng benzen nên k + 1 ≥ 4 —> k ≥ 3
nBr2 = (k – 2).nX + (k + 1 – 2).nY + (k + 1 – 4).nZ = 0,4 (1)
nX + nY = 0,27 (2)
Nếu k = 3 kết hợp (1)(2) —> nX = 0,14; nY = 0,13
Đặt x, y, z là số mol CH2 mà X, Y, Z tương ứng được nhận thêm —> x ≥ 2, y ≥ 2, z ≥ 0
nCH2 = 0,14x + 0,13y + 0,17z = 0,67
—> x = 2, y = 3, z = 0 là nghiệm duy nhất.
X là (COOCH3)2.2CH2 – H2 (0,14)
Y là (COOCH3)2.3CH2 – 2H2 (0,13)
Z là CH3COOC6H5 (0,17)
Este có số mol nhỏ nhất là Y —> %Y = 31,91%
Nếu k ≥ 4 kết hợp (1)(2) —> Vô nghiệm.
Chọn D
Câu 38:
Este X mạch hở, có công thức phân tử C10H12O6. Thực hiện chuỗi phản ứng sau (theo đúng tỉ lệ mol).
(1) X + 3NaOH → X1 + X2 + X3 + X4
(2) X1 + NaOH (CaO, t°) → CH4 + Na2CO3
(3) X2 + H2SO4 → Y + Na2SO4
(4) Y + 2CH3OH → C6H6O4 + 2H2O
Biết X3, X4 có cùng số nguyên tử cacbon (MX3 < MX4).
Cho các phát biểu sau:
(a) Tên gọi của X1 là natri axetat.
(b) Phân tử khối của Y là 114.
(c) X4 hòa tan được Cu(OH)2 ở nhiệt độ thường.
(d) Có 2 công thức cấu tạo thỏa mãn chất X.
(e) Đốt cháy X2 thu được CO2, Na2CO3 và H2O.
(g) Để điều chế X4, cho etilen tác dụng với dung dịch KMnO4.
(h) X3 có trong thành phần của xăng sinh học E5.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(2) —> X1 là CH3COONa
(3) —> X2 có 2Na
(4) —> C6H6O4 là C2(COOCH3)2
—> Y là C2(COOH)2 và X2 là C2(COONa)2
X3, X4 có cùng số nguyên tử cacbon nên mỗi chất 2C
X là CH3COO-CH2-CH2-OOC-C≡C-COO-C2H5
MX3 < MX4 —> X3 là C2H5OH và X4 là C2H4(OH)2
(a)(b)(c) Đúng
(d) Sai, X có cấu tạo duy nhất
(e) Sai, đốt cháy X2 không tạo H2O.
(g) Đúng: C2H4 + KMnO4 + H2O —> C2H4(OH)2 + MnO2 + KOH
(h) Đúng
Chọn D
Câu 39:
Hỗn hợp E gồm C17HxCOOH, C17Hx+2COOH và triglixerit X (tỉ lệ mol lần lượt là 3 : 2 : 1). Đốt cháy hoàn toàn m gam hỗn hợp E thu được 1,45 mol CO2 và 1,38 mol H2O. Mặt khác, hiđro hoá hoàn toàn m gam E rồi cho toàn bộ sản phẩm phản ứng vừa đủ với dung dịch chứa KOH 0,5M và NaOH 0,3M, thu dung dịch chứa bốn muối có khối lượng là 25 gam. Khối lượng của triglixerit X trong m gam hỗn hợp E là
 Xem đáp án
Xem đáp án
nC17HxCOOH = 3a; nC17Hx+2COOH = 2a và nX = a
nH2 phản ứng = b; nKOH = 5c; nNaOH = 3c
nX = a = [1,45 – (1,38 + b)]/2
3a + 2a + 3a = 5c + 3c
Bảo toàn khối lượng:
(1,45.12 + 1,38.2 + 32.8c + 2b) + 56.5c + 40.3c = 25 + 18.5a + 92a
—> a = 0,01; b = 0,05; c = 0,01
C17HxCOOH chắc chắn không no nên nH2 = nC17HxCOOH + 2nX
—> x = 33 và X có dạng CnH2n-8O6
nCO2 = 18.3a + 18.2a + na = 1,45 —> n = 55
mX = a(14n + 88) = 8,58
Chọn A
Câu 40:
Dẫn 0,45 mol hỗn hợp gồm khí CO2 và hơi nước qua cacbon nung đỏ thu được 0,65 mol hỗn hợp X gồm CO, H2 và CO2. Cho toàn bộ X vào dung dịch chứa 0,1 mol NaOH và a mol Ba(OH)2, sau phản ứng hoàn toàn thu được kết tủa và dung dịch Y. Cho từ từ dung dịch HCl vào Y, sự phụ thuộc số mol khí CO2 và số mol HCl được biểu diễn theo đồ thị sau:
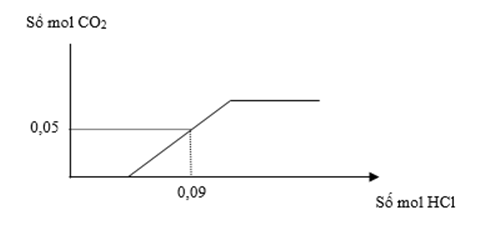
Giá trị của a là
 Xem đáp án
Xem đáp án
nC phản ứng = 0,65 – 0,45 = 0,2
Bảo toàn electron: 4nC phản ứng = 2nCO + 2nH2
—> nCO + nH2 = 0,4 —> nCO2 = 0,65 – 0,4 = 0,25
Cho HCl vào Y một thời gian mới có khí nên Y chứa CO32- —> Y không chứa Ba2+.
Mặt khác nHCl < 2nCO2 nên Y không chứa OH-.
Y chứa Na2CO3 (u) và NaHCO3 (v)
Bảo toàn Na —> 2u + v = 0,1
nHCl = u + 0,05 = 0,09
—> u = 0,04; v = 0,02
Bảo toàn C —> nBaCO3 = 0,25 – (u + v) = 0,19
—> a = 0,19
Chọn B
