(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Sơn La (Lần 2) có đáp án
(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Sơn La (Lần 2) có đáp án
-
879 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 3:
Dung dịch nào dưới đây khi phản ứng hoàn toàn với dung dịch Ba(OH)2 dư, thu được hỗn hợp kết tủa trắng?
 Xem đáp án
Xem đáp án
Dung dịch Ca(HCO3)2 khi phản ứng hoàn toàn với dung dịch Ba(OH)2 dư, thu được hỗn hợp kết tủa trắng:
Ca(HCO3)2 + Ba(OH)2 → CaCO3↓ + BaCO3↓ + H2O
Chọn A
Câu 4:
Kim loại nào sau đây có tính dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Độ dẫn điện: Ag > Cu > Au > Al > Fe → Kim loại dẫn điện tốt nhất là Ag.
Chọn A
Câu 5:
Chất nào sau đây trong phân tử có số nguyên tử cacbon bằng số nguyên tử oxi?
 Xem đáp án
Xem đáp án
Chọn B
Câu 8:
Cho Na vào dung dịch H2SO4 loãng, dư thu được khí X, khí X là chất nào sau đây?
 Xem đáp án
Xem đáp án
Cho Na vào dung dịch H2SO4 loãng, dư thu được khí H2:
Na + H2SO4 → Na2SO4 + H2
Chọn A
Câu 9:
Cho thanh kim loại Mg vào dung dịch chất nào sau đây chỉ xảy ra hiện tượng ăn mòn hóa học?
 Xem đáp án
Xem đáp án
Cho thanh kim loại Mg vào dung dịch HNO3 chỉ xảy ra hiện tượng ăn mòn hóa học do không có đủ 2 điện cực để xảy ra ăn mòn điện hóa.
Chọn B
Câu 12:
Nhôm bền trong không khí và nước do trên bề mặt của nhôm được phủ kín lớp chất X rất mỏng, bền. Chất X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 15:
Nước cứng tạm thời tác dụng với chất nào sau đây không thu được kết tủa?
 Xem đáp án
Xem đáp án
A. M(HCO3)2 + Ca(OH)2 → MCO3 + CaCO3 + H2O
B. M(HCO3)2 + Na3PO4 → M3(PO4)2 + NaHCO3
C. M(HCO3)2 + Na2CO3 → MCO3 + NaHCO3
D. M(HCO3)2 + HCl → MCl2 + CO2 + H2O
Chọn D
Câu 18:
Cho MgCO3 tác dụng với dung dịch HCl thu được chất khí X. Chất X là
 Xem đáp án
Xem đáp án
Cho MgCO3 tác dụng với dung dịch HCl thu được khí CO2:
MgCO3 + HCl → MgCl2 + CO2 + H2O
Chọn B
Câu 19:
Sau khi thực hành hóa học, trong 1 số chất thải dạng dung dịch có chứa các ion Cu2+, Zn2+, Fe2+, Pb2+, Hg2+… Dùng hóa chất nào sau đây có thể xử lí sơ bộ các chất thải trên?
 Xem đáp án
Xem đáp án
Dùng Ca(OH)2 có thể xử lí sơ bộ các chất thải trên:
M2+ + OH- → M(OH)2 (M2+ là Cu2+, Zn2+, Fe2+, Pb2+, Hg2+…)
Chọn B
Câu 20:
Chất nào sau đây không dùng làm chất khử khi điều chế kim loại theo phương pháp nhiệt luyện?
 Xem đáp án
Xem đáp án
Chọn B
Câu 21:
Một hỗn hợp X gồm hai chất hữu cơ đơn chức. Cho X phản ứng vừa đủ với 500 ml dung dịch KOH 1M. Sau phản ứng, thu được hỗn hợp Y gồm hai muối của hai axit cacboxylic và một ancol. Cho toàn bộ lượng ancol thu được ở trên tác dụng với Na (dư), sinh ra 3,36 lít H2. Hỗn hợp X gồm
 Xem đáp án
Xem đáp án
nKOH = 0,5; nH2 = 0,15 → nAncol = 0,3
nAncol < nKOH nên ban đầu có 1 chất tác dụng với KOH nhưng không tạo ancol.
→ Hai chất ban đầu gồm một este và một axit.
Chọn D
Câu 22:
Để phản ứng vừa đủ với 0,2 mol amino axit X cần 200 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được 22,2 gam chất rắn khan. Amino axit X là
 Xem đáp án
Xem đáp án
nNaOH = nX → X có 1COOH
M muối = 22,2/0,2 = 111 → MX = 111 – 22 = 89: X là alanin.
Chọn C
Câu 23:
Tinh thể chất X không màu, vị ngọt, dễ tan trong nước. X có nhiều trong mật ong nên làm cho mật ong có vị ngọt sắc. Trong công nghiệp, X được điều chế bằng phản ứng thủy phân chất Y. Tên gọi của X và Y lần lượt là
 Xem đáp án
Xem đáp án
X không màu, vị ngọt, dễ tan trong nước. X có nhiều trong mật ong nên làm cho mật ong có vị ngọt sắc → X là fructozơ (C6H12O6)
Thủy phân Y tạo X nên Y là saccarozơ (C12H22O11):
Saccarozơ + H2O → Glucozơ + Fructozơ
Chọn A
Câu 24:
Cho m gam hỗn hợp X gồm Mg, Fe, Cu tác dụng với oxi, thu được 47,2 gam hỗn hợp Y chỉ gồm các oxit kim loại. Hòa tan hết Y bằng dung dịch H2SO4 loãng, dư thu được dung dịch Z. Cho toàn bộ Z vào dung dịch NaOH dư, thu được 61,6 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Cứ 1O trong Y sẽ được thay thế bởi 2OH trong kết tủa.
nO(Y) = (61,6 – 47,2)/(17.2 – 16) = 0,8
→ mX = mY – mO(Y) = 34,4 gam
Chọn D
Câu 25:
Cho 200 ml dung dịch Ba(OH)2 0,06M vào 100 ml dung dịch chứa KHCO3 0,25M và BaCl2 0,1M, sau các phản ứng hoàn toàn thu được a gam kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
nBa(OH)2 = 0,012; nKHCO3 = 0,025; nBaCl2 = 0,01
→ nBa2+ = 0,022; nHCO3- = 0,025 và nOH- = 0,024
Ba2+ + HCO3- + OH- → BaCO3 + H2O
→ nBaCO3 = 0,022 → mBaCO3 = a = 4,334 gam
Chọn A
Câu 26:
Este X có công thức phân tử C5H10O2. Thủy phân X trong dung dịch H2SO4 loãng, đun nóng, thu được sản phẩm gồm axit axetic và chất hữu cơ Y. Công thức của Y là
 Xem đáp án
Xem đáp án
C5H10O2 (X) + H2O → CH3COOH
→ X là CH3COOC3H7 → Y là C3H7OH
Chọn C
Câu 27:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Đúng
B. Sai, trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất.
C. Đúng: (NH2)2CO + Ca(OH)2 → CaCO3 + 2NH3
D. Đúng, tại anot: 2Cl- → Cl2 + 2e
Chọn B
Câu 28:
Cho 4 chất rắn riêng biệt: NaOH, Fe, Cu và AgNO3. Số chất rắn có khả năng phản ứng được với dung dịch FeCl3 là
 Xem đáp án
Xem đáp án
Cả 4 chất rắn có khả năng phản ứng được với dung dịch FeCl3:
NaOH + FeCl3 → Fe(OH)3 + NaCl
Fe + FeCl3 → FeCl2
Cu + FeCl3 → FeCl2 + CuCl2
AgNO3 + FeCl3 → Fe(NO3)3 + AgCl
Chọn B
Câu 29:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, xenlulozơ trinitrat chỉ được dùng làm thuốc súng không khói.
B. Sai, tơ nilon-6,6 có nhóm amit (-CONH-) nên kém bền trong môi trường axit và kiềm.
C. Đúng, thủy phân hoàn toàn xenlulozơ chỉ thu được 1 monosaccarit là glucozơ.
D. Sai, phân tử amilozơ có cấu trúc mạch không phân nhánh.
Chọn C
Câu 30:
Lên men dung dịch chứa 600 gam glucozơ thu được 184 gam ancol etylic. Hiệu suất quá trình lên men tạo thành ancol etylic là
 Xem đáp án
Xem đáp án
C6H12O6 → 2C2H5OH + 2CO2
nC2H5OH = 4 → nC6H12O6 phản ứng = 2
→ H = 2.180/600 = 60%
Chọn D
Câu 31:
Thực hiện các thí nghiệm sau:
(1) Cho a mol Na2O vào dung dịch chứa 2a mol CuSO4.
(2) Cho dung dịch chứa a mol Ba(HCO3)2 vào dung dịch chứa 3a mol KOH.
(3) Cho hỗn hợp gồm a mol Ba và a mol Al vào lượng nước dư.
(4) Cho a mol Mg vào dung dịch chứa a mol Fe2(SO4)3.
(5) Cho từ từ a mol HCl vào dung dịch chứa a mol Na2CO3.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được dung dịch chứa hai chất tan có nồng độ mol bằng nhau là
 Xem đáp án
Xem đáp án
Hai chất tan có nồng độ mol bằng nhau → 2 chất tan có số mol bằng nhau.
(1) Na2O + H2O → 2NaOH
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
Chất tan: nNa2SO4 = nCuSO4 dư = a
(2) Ba(HCO3)2 + 2KOH → BaCO3 + K2CO3 + 2H2O
Chất tan: nK2CO3 = nKOH dư = a
(3) Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2
Chất tan: nBa(AlO2)2 = nBa(OH)2 dư = 0,5a
(4) Mg + Fe2(SO4)3 → MgSO4 + 2FeSO4
Chất tan: nMgSO4 = a và nFeSO4 = 2a
(5) HCl + Na2CO3 → NaHCO3 + NaCl
Chất tan: nNaHCO3 = nNaCl = a
Chọn A
Câu 32:
Hỗn hợp X gồm Fe, FeO, Fe2O3, Mg và MgO. Hòa tan hết a gam hỗn hợp X vào dung dịch H2SO4 đặc, nóng (dư 10% so với lượng phản ứng), thu được dung dịch Y và 1,68 lít khí SO2 (sản phẩm khử duy nhất của H2SO4). Cho Y tác dụng với dung dịch Ba(OH)2 dư, thu được 45,378 gam kết tủa. Mặt khác, hòa tan a gam hết hỗn hợp X cần dùng 53,75 gam dung dịch HCl 14,6%, thu được 1,064 lít khí H2 và dung dịch Z chỉ chứa các muối. Cho tiếp dung dịch AgNO3 dư vào Z thu được m gam kết tủa gồm Ag và AgCl. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nHCl = 53,75.14,6%/36,5 = 0,215; nH2 = 0,0475
Bảo toàn H: nHCl = 2nH2 + 2nH2O
→ nO(X) = nH2O = 0,06
nSO2 = 0,075
Quy đổi X thành Mg (x), Fe (y) và O (0,06)
Bảo toàn electron: 2x + 3y = 2.0,06 + 0,075.2 (1)
nH2SO4 phản ứng = 2nSO2 + nO = 0,21
→ nH2SO4 ban đầu = 0,21 + 0,21.10% = 0,231
m↓ = 58x + 107y + 233(0,231 – 0,075) = 45,378 (2)
(1)(2) → x = 0,045; y = 0,06
Bảo toàn electron: 2x + 3y = 2nO + 2nH2 + nAg → nAg = 0,055
nAgCl = nHCl = 0,215 → m↓ = 36,7925 gam
Cách khác:
nAgCl = nHCl = 0,215
Bảo toàn electron: 2nSO2 = 2nH2 + nAg → nAg = 0,055
→ m↓ = 36,7925 gam
Chọn C
Câu 33:
Cho các phát biểu sau:
(a) Benzyl axetat có mùi thơm của hoa nhài.
(b) Chất béo là đieste của glixerol với axit béo.
(c) Cao su lưu hóa có cấu trúc mạng không gian.
(d) Để phân biệt dung dịch glucozơ và fructozơ có thể dùng dung dịch AgNO3 trong NH3 đun nóng.
(đ) Số nguyên tử O trong tripeptit mạch hở Glu-Val-Ala là 6.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Sai, chất béo là trieste của glixerol với axit béo.
(c) Đúng
(d) Sai, cả glucozơ và fructozơ đều tráng gương. Để phân biệt dung dịch glucozơ và fructozơ có thể dùng dung dịch Br2.
(đ) Đúng, số O = 4 + 2 + 2 – 2 = 6 nguyên tử.
Chọn B
Câu 34:
Cho sơ đồ chuyển hóa sau (theo đúng tỉ lệ mol):
(a) X1 + X2 → X3 + X4 + H2O.
(b) X1 + 2X2 → X3 + X5 + 2H2O
(c) X1 + X5 → X3 + 2X4
Trong dãy các cặp chất sau: Ca(HCO3)2 và KOH; Ca(OH)2 và KHCO3; Ba(HCO3)2 và NaHSO4; Ba(OH)2 và NaH2PO4, số cặp chất thỏa mãn với X1 và X2 trong sơ đồ trên là
 Xem đáp án
Xem đáp án
Xét Ca(HCO3)2 và KOH: X3 là CaCO3, X4 là KHCO3; X5 là K2CO3 (Thỏa mãn)
Xét Ca(OH)2 và KHCO3: X3 là CaCO3, X4 là KOH, X5 là K2CO3 (Thỏa mãn)
Xét Ba(HCO3)2 và NaHSO4: Không thỏa mãn (a) do có CO2.
Xét Ba(OH)2 và NaH2PO4: Không thỏa mãn (a):
3Ba(OH)2 + 3NaH2PO4 → Ba3(PO4)2 + Na3PO4 + 6H2O
Chọn C
Câu 35:
Điện phân dung dịch chứa x mol CuSO4, y mol H2SO4 và z mol NaCl (với điện cực trơ, màng ngăn xốp, hiệu suất điện phân là 100%, cường độ dòng điện 2,0A). Thời gian điện phân và khối lượng Al2O3 bị hoà tan tối đa trong dung dịch sau điện phân ứng với đồ thị sau:
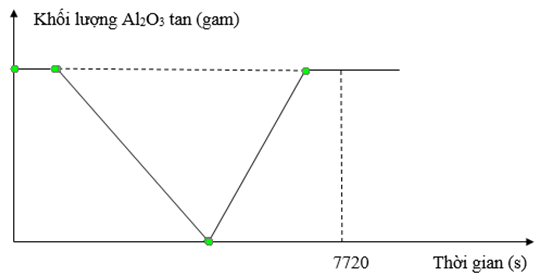
Biết tại thời điểm 7720 (s) khối lượng dung dịch điện phân giảm 5,98 gam và có 0,13 mol khí thoát ra. Giá trị (x + y + z) là
 Xem đáp án
Xem đáp án
Đoạn 1: CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
Đoạn 2: H2SO4 + 2NaCl → H2 + Cl2 + Na2SO4
Đoạn 3: 2H2O + 2NaCl → H2 + Cl2 + 2NaOH
Đoạn 4: Điện phân nước ở 2 điện cực, tạo H2, O2.
Lúc t = 7720 → ne = 0,16
Catot: nCu = x → nH2 = 0,08 – x
Anot: nCl2 = 0,5z → nO2 = 0,04 – 0,25z
n khí tổng = 0,08 – x + 0,5z + 0,04 – 0,25z = 0,13
m giảm = 64x + 2(0,08 – x) + 35,5z + 32(0,04 – 0,25z) = 5,98
→ x = 0,02; z = 0,12
Lượng Al2O3 bị hòa tan bởi H+ và bởi OH- như nhau nên: nH+ = 6nAl2O3; nOH- = 2nAl2O3 → nH+ = 3nOH-
⇔ 2y = 3.2(0,5z – x – y) (Trong đó: nOH- = 2nCl2 đoạn 3)
→ y = 0,03
→ x + y + z = 0,17
Chọn C
Câu 36:
Hỗn hợp X chứa ba este đều mạch hở (chỉ chứa chức este), trong mỗi phân tử este đều có số liên kết π không quá 5. Đun nóng m gam X cần dùng 1,0 lít dung dịch NaOH 1M, thu được hỗn hợp Y gồm các ancol đơn chức thuộc cùng dãy đồng đẳng và (0,8m + 12,28) gam hỗn hợp Z gồm hai muối của hai axit cacboxylic có mạch không phân nhánh, trong đó có a gam muối T và b gam muối E (MT < ME). Nung nóng Z với vôi tôi xút (dùng dư) thu được hỗn hợp khí nặng 8,2 gam. Mặt khác, đốt cháy hoàn toàn m gam X cần dùng 3,55 mol O2. Giá trị của b là
 Xem đáp án
Xem đáp án
nNaOH = 1
Phản ứng vôi tôi xút thay thế COONa bằng H nên:
m muối = 8,2 + 1(67 – 1) = 0,8m + 12,28
→ m = 77,4
Bảo toàn khối lượng → mAncol = 43,2
→ M ancol = 43,2 → Có CH3OH → Ancol dạng CnH2n+1OH với n = 1,8
Quy đổi muối thành COONa (1), C (u), H (v)
m muối = 67 + 12u + v = 74,2
nO2 = 1.0,25 + u + 0,25v + 1.1,5n = 3,55
→ u = 0,6; v = 0
Muối không quá 5π → (COONa)2 (0,2) và C2(COONa)2 (0,3)
→ mC2(COONa)2 = 47,4 gam
Chọn C
Câu 37:
Sản xuất phân supephotphat kép thường sử dụng quặng photphorit (có thành phần chính là Ca3(PO4)2) và dung dịch H2SO4 70% theo các giai đoạn sau:
- Giai đoạn 1: Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4↓
- Giai đoạn 2: Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Phân lân thu được sau hai giai đoạn trên chứa Ca(H2PO4)2 và các chất khác không chứa photpho. Độ dinh dưỡng của phân lân đó là 42,6%. Để sản xuất 10 tấn phân lân trên cần tối thiểu m tấn dung dịch H2SO4 70%. Biết hiệu suất của giai đoạn 1 là 80%, giai đoạn 2 là 70%. Giá trị của m là
 Xem đáp án
Xem đáp án
Phản ứng gộp:
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
nCa(H2PO4)2 = nP2O5 = 10000.42,6%/142 = 30 kmol
→ nH2SO4 phản ứng = 60 kmol
→ mdd H2SO4 cần dùng = 60.98/70%.80%.70% = 15000 kg = 15 tấn
Chọn A
Câu 38:
Từ chất hữu cơ X đa chức có CTPT C11H10O4 thực hiện các phản ứng sau theo đúng tỉ lệ mol của các chất khi phản ứng tối đa:
(1) X + 3NaOH → Y + Z + T + H2O
(2) Y + HCl → Y1 + NaCl
(3) Z + H2SO4 → Z1 + Na2SO4
(4) T + 2AgNO3 + 3NH3 + H2O → T1 + 2NH4NO3 + 2Ag
(5) T1 + NaOH → Y + NH3 + H2O
Cho các phát biểu sau:
(a) Chỉ có một công thức cấu tạo thỏa mãn X.
(b) Z là hợp chất hữu cơ đa chức.
(c) Y và T có cùng số nguyên tử cacbon.
(d) X có khả năng làm mất màu nước brom.
(e) Trùng ngưng Z1 với etylen glicol thu được poli (etylen terephtalat).
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Theo các phản ứng trên thì Y có 1Na, Z có 2Na, Y và T cùng C và ít nhất 2C.
T1 là muối amoni cacboxylat nên Y1 là axit cacboxylic
Xà phòng hóa X tạo H2O nên X có 1 chức este của phenol. X là:
CH3COO-C6H4-COO-CH=CH2 (o, m, p)
Y là CH3COONa; Z là NaO-C6H5-COONa; T là CH3CHO
Y1 là CH3COOH; Z1 là HO-C6H5-COOH; T1 là CH3COONH4.
(a) Sai, X có 3 cấu tạo thỏa mãn.
(b) Sai, Z là chất tạp chức
(c) Đúng, Y và T đều có 2C
(d) Đúng, X có C=C nên làm mất màu Br2
(e) Sai, Z1 không trùng ngưng cùng C2H4(OH)2 được.
Chọn D
Câu 39:
Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hiđro, cacbon monooxit, metanol, etanol, propan,…) bằng oxi không khí. Trong pin propan - oxi, phản ứng tổng cộng xảy ra khi pin hoạt động như sau:
C3H8 (khí) + 5O2 (khí) + 6OH- (dung dịch) → 3CO32- (dung dịch) + 7H2O (lỏng)
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol propan theo phản ứng trên thì sinh ra một lượng năng lượng là 2500,00 kJ. Một bóng đèn công suất 10W được thắp sáng bằng pin nhiên liệu propan - oxi. Biết hiệu suất quá trình oxi hóa propan là 80,0%; hiệu suất sử dụng năng lượng là 100%. Khi sử dụng 220 gam propan làm nhiên liệu ở điều kiện chuẩn, thì thời gian (giờ) bóng đèn được thắp sáng liên tục gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
10W = 10 J/s = 36 kJ/h
nC3H8 = 5, thời gian đèn sáng là x giờ. Bảo toàn năng lượng:
2500.5.80% = 36x → x = 278 giờ.
Chọn C
Câu 40:
Hỗn hợp T gồm 2 triglixerit X và Y (MX < MY). Cho m gam T phản ứng vừa đủ với dung dịch NaOH 1M thu được glixerol và hỗn hợp muối M gồm 3 muối (C15H31COONa, C17HaCOONa và C17HbCOONa) có tỉ lệ mol không tương ứng là 3 : 5 : 7. Đốt cháy hoàn toàn hỗn hợp M trong oxi dư thu được 7,95 gam Na2CO3; 44,19 gam nước và 2,525 mol CO2. Biết X và Y hơn kém nhau 1 liên kết π trong phân tử. Phần trăm khối lượng của X trong T là
 Xem đáp án
Xem đáp án
nNa2CO3 = 0,075 → n muối = nNaOH = 0,15
nCO2 = 2,525; nH2O = 2,455
Số C = (0,075 + 2,525)/0,15 = 17,33
→ nC16 = 0,05 và nC18 = 0,1
nH2 làm no chất béo = nCO2 – nH2O = 0,07
nT = nNaOH/3 = 0,05
k (chất béo) = 3 + 0,07/0,05 = 4,4
→ k = 4 (0,03 mol) và k = 5 (0,02 mol)
→ Mỗi chất béo có 1 gốc C15H31COO-.
X là (C15H31COO)(C17H35COO)2C3H5 – 2H2 (0,02 mol)
Y là (C15H31COO)(C17H35COO)2C3H5 – H2 (0,03 mol)
→ mX = 0,02.862 – 0,02.2.2 = 17,16
mT = 0,05.862 – 0,07.2 = 42,96
→ %X = 17,16/42,96 = 39,94%
Chọn A
