(2023) Đề thi thử Hóa Học THPT soạn theo ma trận đề minh họa BGD ( Đề 7) có đáp án
(2023) Đề thi thử Hóa Học THPT soạn theo ma trận đề minh họa BGD ( Đề 7) có đáp án
-
740 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 7:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 9:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 12:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 13:
Vào mùa đông, nhiều gia đình sử dụng bế than đặt trong phòng kín để sưởi ấm gây ngộ độc khí, cỏ thế dẫn tới tử vong. Nguyên nhản gây ngộ độc là do khí nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 14:
Đun nóng triglixerit trong dung dịch NaOH dư đến phản ứng hoàn toàn luôn thu được chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 17:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 18:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 19:
Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường kiềm là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 21:
Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 và m gam chất rắn không tan. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án B
Cu không tác dụng HCl
nZn = 0,2 ® mZn = 13 gam ® mCu = 15 – 13 = 2 gam
Câu 24:
Cho m gam dung dịch glucozơ 1% vào lượng dư dung dịch AgNO3 trong NH3, đun nóng nhẹ đến phản ứng hoàn toàn thu được 2,16 gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
m Glucozo = = 180 gam
Câu 25:
Cho 22,5 gam amino axit X (công thức có dạng H2NCnH2nCOOH) tác dụng hết với dung dịch HCl dư, thu được 33,45 gam muối. Số nguyên tử hiđro trong phân tử X là
 Xem đáp án
Xem đáp án
Đáp án D
H2NCnH2nCOOH + HCl ® ClH3NCnH2nCOOH
(mol) ® Maa = 75 (H2NCH3COOH)
Câu 26:
X và Y là hai cacbohiđrat. X là chất rắn, ở dạng bột vô định hình, màu trắng, không tan trong nước lạnh. Y là loại đường phổ biến nhất, có trong nhiều loài thực vật, có nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt. Tên gọi của X, Y lần lượt là:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 27:
Hòa tan hoàn toàn 6,3 gam hỗn hợp Mg và Al trong dung dịch HNO3 loãng dư, sau phản ứng thu được 1,68 lít khí X có tỉ khối so với He là 11 (là sản phẩm khử duy nhất ở đktc). Phần trăm khối lượng Al trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Đáp án A
Mx = 11 . 4 = 44 (N2O) ®
Câu 28:
Vitamin A (retinol) rất cần thiết đối với sức khỏe con người, vitamin A là chất không tan trong nước, hòa tan tốt trong chất béo. Công thức của vitamin A như sau:
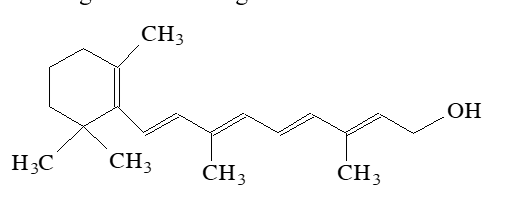
Nhận định nào sau đây về vitamin A là đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 29:
Cho dãy các chất: Fe(OH)2, FeO, Fe(NO3)3, Fe, FeCl3. Số chất trong dãy phản ứng được với dung dịch HCl là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 30:
Este X có tỉ khối hơi so với H2 bằng 21,5. Cho 25,8 gam X tác dụng với dung dịch NaOH dư, thu được dung dịch chứa 28,2 gam muối. Công thức của X là
 Xem đáp án
Xem đáp án
Đáp án C
Meste = 86 (C4H6O2) ® neste = 0,3 mol ® MRCOONa = 94 (C2H3COONa)
Câu 31:
Cho các phát biểu sau:
(a) Tinh bột, tripanmitin và lòng trắng trứng đều bị thủy phân trong môi trường kiềm, đun nóng.
(b) Thủy tinh hữu cơ (plexiglas) được ứng dụng làm cửa kính ô tô.
(c) Etyl axetat được dùng làm dung môi để tách, chiết các chất hữu cơ.
(d) Ở điều kiện thường, etyl axetat là chất lỏng, tan nhiều trong nước.
(e) Metylamin có lực bazơ lớn hơn lực bazơ của etylamin.
(f) Gly-Ala và Gly-Ala-Gly đều có phản ứng với Cu(OH)2 tạo ra hợp chất màu tím.
(g) Có ba chất hữu cơ đơn chức, mạch hở ứng với công thức phân tử C3H6O2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
a. Sai vì tinh bột không bị thủy phân trong môi trường kiềm.
b. Đúng.
c. Đúng.
d. Sai vì không tan trong nước.
e. Sai lực bazo yếu hơn.
f. Sai vì từ tripeptit mới tạo phức màu tím.
g. Đúng (3 chất hữu cơ đơn chức, mạch hở có CTPT C3H6O2 là: C2H5COOH, HCOOC2H5 và CH3COOCH3).
Câu 32:
(a) Cho dung dịch Ba(OH)2 tới dư vào dung dịch FeCl3.
(b) Cho dung dịch KHSO4 vào dung dịch BaCl2.
(c) Sục khí H2S tới dư vào dung dịch FeCl3.
(d) Cho kim loại Zn vào lượng dư dung dịch FeCl3.
(e) Sục khí CO2 tới dư vào dung dịch Ca(OH)2.
(f) Cho kim loại Fe vào dung dịch AgNO3 dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Đáp án A
a.Tạo Fe(OH)3 kết tủa nâu đỏ
b.Tạo BaSO4 kết tủa trắng.
c.Tạo S kết tủa.
d. Zn + 2FeCl3 dư → ZnCl2 + 2FeCl2
e. 2CO2 dư + Ca(OH)2 → Ca(HCO3)2
f. Tạo Ag kết tủa.
Câu 33:
Một đồi có diện tích 1000 m2 trồng cây keo với mật độ 10m2/ cây, trung bình mõi cây khai thác 243 kg gỗ (chứa 50% xenlulozo về khối lượng). Ứng với quá trình tạo ra lượng xenlulozo ở khu keo trên, cây đã hấp thụ a m3 khí CO2 và giải phóng b m3 khí O2 ở điều kiện thường? Biết 1 mol khí ở điều kiện thường chiếm 24,4 lít. Tổng a + b là bao nhiêu:
 Xem đáp án
Xem đáp án
Đáp án B
Số cây trên đồi cây
Khối lượng gỗ khai thác được = 100. 243 = 24300 kg
Quy đổi xenlu thành
Câu 34:
Đun nóng a gam hỗn hợp E chứa triglixerit X và các axit béo tự do với 150 ml dung dịch NaOH 2M (vừa đủ), thu được hỗn hợp Y chứa các muối có công thức chung C17HyCOONa. Đốt cháy 0,07 mol E thu được 1,845 mol CO2. Mặt khác m gam E tác dụng vừa đủ với 0,1 mol H2. Các phản ứng xảy ra hoàn toàn. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 35:
Xăng sinh học E10 là nhiên liệu hỗn hợp giữa 10% etanol và 90% octan về khối lượng, còn có tên là gasohol. Hiện nay có khoảng 40 nước trên thế giới đang sử dụng nhiên liệu này trong các động cơ đốt trong của xe hơi và phương tiện giao thông tải trọng nhẹ. Biết rằng nhiệt lượng cháy (nhiệt tỏa ra trong quá trình đốt cháy) của nhiên liệu đo ở điều kiện tiêu chuẩn (25oC, 100kPa) được đưa trong bảng dưới đây:
|
Nhiên liệu |
Công thức |
Trạng thái |
Nhiệt lượng cháy (kJ.g-1) |
|
Etanol |
C2H5OH |
Lỏng |
29,6 |
|
Octan |
C8H18 |
Lỏng |
47,9 |
Để sản sinh năng lượng khoảng 2396 MJ thì cần đốt cháy hoàn toàn bao nhiêu tấn xăng E10 ở điều kiện tiêu chuẩn?
 Xem đáp án
Xem đáp án
Đáp án B
Gọi khối lượng xăng E10 cần đốt là x (gam)
Câu 36:
Hòa tan hoàn toàn 17,46 gam hỗn hợp gồm AgNO3 và Cu(NO3)2.aH2O vào nước được dung dịch X. Nhúng thanh kim loại sắt vào dung dịch X, phản ứng kết thúc thấy khối lượng kim loại bám vào thanh sắt là m gam. Mặt khác, nhiệt phân hoàn toàn 17,46 gam hỗn hợp muối trên thu được 8,88 gam chất rắn Z. Để hòa tan hết lượng chất rắn Z cần dùng vừa đủ 61,25 ml dung dịch HNO3 12% (d = 1,2 g/ml) sau phản ứng thu được khí NO (sản phẩm khử duy nhất). Cho biết các phản ứng xảy ra hoàn toàn, giải thiết kim loại sinh ra đều bám hết trên thanh sắt. Xác định a và tính m.
 Xem đáp án
Xem đáp án
Đáp án B
Cu(NO3)2.aH2O → CuO + 2NO2 + 0,5O2 + aH2O
AgNO3 → Ag + NO2 + 0,5O2
B gồm CuO (u) và Ag (v) → 80u + 108v = 8,88
CuO + 2HNO3 → Cu(NO3)2 + H2O
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
nHNO3 = 2u + 4v/3 = 61,25.1,2.12%/63
→ u = 0,03; v = 0,06 → 0,03(18a + 188) + 0,06.170 = 17,46 → a = 3
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Khối lượng kim loại bám vào đinh sắt: m = 0,06.108 + 0,03.64 = 8,4 gam
Câu 37:
Đốt cháy hoàn toàn 15,48 gam hỗn hợp Q gồm ba este X, Y, Z (MX < MY < MZ < 200 đvC) thu được 0,64 mol CO2 và 0,38 mol H2O. Mặt khác, xà phòng hoá hoàn toàn 15,48 gam X với dung dịch NaOH (vừa đủ), thu được 5,64 gam hỗn hợp E gồm hai ancol (tỉ lệ mol 1 : 3) và dung dịch chứa 19,52 gam hỗn hợp F gồm ba muối. Đốt cháy hoàn toàn F thu được Na2CO3, H2O và 14,52 gam CO2. Phần trăm số mol của Z trong hỗn hợp Q gần nhất là
 Xem đáp án
Xem đáp án
Đáp án C
nCOO-Ancol = u và nCOO-phenol = v
mQ = 16(2u + 2v) + 0,64.12 + 0,38.2 = 15,48
nNaOH = u + 2v; nH2O = v, bảo toàn khối lượng:
15,48 + 40(u + 2v) = 5,64 + 19,52 + 18v → u = 0,18; v = 0,04
nNaOH = 0,26 → nNa2CO3 = 0,13 → nC(muối) = nNa2CO3 + nCO2 = 0,46 → nC(Ancol) = 0,64 – 0,46 = 0,18
nO(Ancol) = u = 0,18 → nH(Ancol) = 0,6
nAncol = nH/2 – nC = 0,12 ® Số C = 0,18/0,12 = 1,5 → Có CH3OH
MX < MY < MZ < 200 đvC nên ancol không quá 3 chức, mặt khác ancol có nC = nO nên:
TH1: CH3OH (0,06) và C2H4(OH)2 (0,06) (Bấm hệ nAncol, mAncol): Loại vì không đúng tỉ lệ 1 : 3.
TH2: CH3OH (0,09) và C3H5(OH)2 (0,03) (Bấm hệ nAncol, mAncol): Thỏa mãn tỉ lệ 1 : 3.
Muối chứa COONa (u + v = 0,22); ONa (0,04); C (0,46 – 0,22 = 0,24) và H (0,34 – Tính từ mF)
Dễ thấy nC = 6nONa nên muối gồm C6H5ONa (0,04), HCOONa (0,34 – 0,04.5 = 0,14) và (COONa)2 (0,04)
Q gồm: Y là (HCOO)3C3H5: 0,03 / Z là C6H5-OOC-COO-CH3: 0,04 / X là HCOOCH3: 0,05
→ %nZ = 33,33%
Câu 38:
Điện phân dung dịch chứa m gam hỗn hợp Cu(NO3)2 và NaCl bằng dòng điện một chiều có cường độ 2A (điện cực trơ, có màng ngăn xốp). Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 3378 |
2t |
|
Tổng số mol khí ở 2 điện cực |
a |
a + 0,035 |
2,0625a |
|
Số mol Cu ở catot |
b |
b + 0,025 |
b + 0,025 |
Giả sử hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m gần nhất với
 Xem đáp án
Xem đáp án
Đáp án C
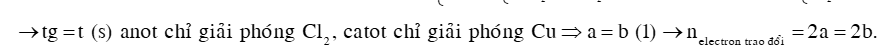
Câu 39:
Cho sơ đồ phản ứng sau:
(1) X + Y → Al(OH)3 + Z
(2) X + T → Z + AlCl3
(3) AlCl3 + Y → Al(OH)3 + T
Các chất X, Y, Z và T tương ứng là
 Xem đáp án
Xem đáp án
Đáp án D
Các chất X, Y, Z và T tương ứng là: Al2(SO4)3; Ba(OH)2; BaSO4 và BaCl2
Câu 40:
Cho các phương trình phản ứng hóa học sau (theo đúng tỉ lệ mol, các phản ứng đều ở điều kiện và xúc tác thích hợp):
(1) X + 2NaOH → X1 + X2 + H2O
(2) X2 + CuO → X3 + Cu + H2O
(3) X3 + 4AgNO3 + 6NH3 + H2O → (NH4)2CO3 + 4Ag + NH4NO3
(4) X1 + 2NaOH → X4 + 2Na2CO3
(5) X4 → PE
Cho các phát biểu sau:
(1) X có 8 nguyên tử H trong phân tử.
(2) X2 được sử dụng để pha vào đồ uống.
(3) X1 tan trong nước tốt hơn so với X.
(4) X4 có phản ứng với AgNO3/NH3 tạo kết tủa Ag.
(5) X2 được dùng làm nguyên liệu để sản xuất axit axetic trong công nghiệp.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Đáp án C
(1) HOOC-C2H2-COOCH3 (X) + 2NaOH C2H2(COONa)2 (X1) + CH3OH (X2) + H2O
(2) CH3OH (X2) + CuO HCHO (X3) + Cu + H2O
(3) HCHO (X3) + 4AgNO3 + 6NH3 + H2O (NH4)2CO3 + 4Ag + 4NH4NO3
(4) C2H2(COONa)2 (X1) + 2NaOH C2H4 (X4) + 2Na2CO3
(5)
(1) Sai vì X có 6 nguyên tử H
(2) Sai vì metanol là chất độc
(3) Đúng vì X1 là hợp chất ion
(4) Sai vì C2H4 không thể tạo kết tủa với AgNO3/NH3
(5) Đúng vì CH3OH + CO CH3COOH
