(2024) Đề minh họa tham khảo BGD môn Hóa có đáp án (16)
-
92 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 8:
Cacbohiđrat nào sau đây là nguyên liệu để sản xuất thuốc súng không khói?
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 10:
Kim loại nào sau đây không phản ứng với nước tạo ở nhiệt độ thường?
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 11:
Khí SO2 là một trong những chất gây ô nhiễm môi trường, có trong khí núi lửa, khí thải của các phương tiện giao thông. Tên của SO2 là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 12:
Cho Zn tác dụng với dung dịch chất nào sau đây có xảy ra ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 18:
Trong công nghiệp, Al được điều chế bằng phương pháp điện phân nóng chảy hợp chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 21:
Cho từ từ đến dư kim loại X vào dung dịch FeCl3, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa hai muối. X là kim loại nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 22:
Tiến hành lên men rượu 162 gam tinh bột, thu được m gam ancol etylic. Biết hiệu suất của quá trình lên men là 60%. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 23:
Hiđro hóa hoàn toàn 43,9 gam trilinolein [(C17H31COO)3C3H5] cần vừa đủ b mol H2. Giá trị của b là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 24:
Cho các chất sau: amilozơ; xenlulozơ; saccarozơ; amilopectin. Số chất chỉ tạo nên từ các mắc xích a-glucozơ là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 25:
Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch sau: HNO3, KCl, Ba(OH)2, NaHSO4. Số trường hợp có phản ứng xảy ra là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 26:
Cho 0,195 gam kim loại R (hóa trị II) tác dụng hết với dung dịch AgNO3 dư, thu được 0,648 gam Ag. Kim loại R là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 27:
Cho 17,8 gam amino axit X tác dụng vừa đủ 200 ml dung dịch HCl 1M. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 28:
Cho các polime sau: poli(vinyl clorua), poli(metyl metacrylat), xenlulozơ triaxetat, cao su buna. Số polime được điều chế từ phản ứng trùng hợp là
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 29:
Điện phân Al2O3 nóng chảy với dòng điện cường độ 9,65A trong thời gian 3000 giây, thu được m gam Al. Biết hiệu suất của phản ứng điện phân đạt 100%. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A.
Câu 30:
Một thí nghiệm được mô tả như hình dưới đây:
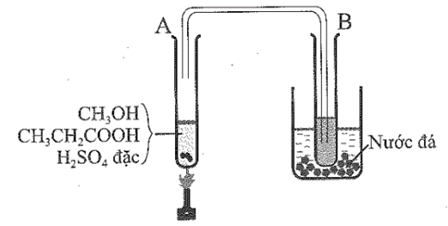
Chất lỏng thu được ở ống nghiệm B có mùi táo. Nhận định nào sau đây sai khi nói về thí nghiệm trên?
 Xem đáp án
Xem đáp án
CH3CH2COOH + CH3OH CH3CH2COOCH3 (metyl propionat) + H2O (xúc tác H2SO4, to)
H2SO4 đặc có vai trò là chất xúc tác và làm tăng hiệu suất phản ứng este hóa.
Nước đá có vai trò tạo môi trường nhiệt độ thấp giúp hơi este ngưng tụ lại trong ống nghiệm BCâu 31:
Chất hữu cơ X có công thức là C3H11O5N3. Cho X tác dụng với dung dịch NaOH thu được khí Y, muối Z và T là muối của amino axit E. Cho các phát biểu sau:
(a) Chất Z là muối natri của axit cacboxylic.
(b) Khí Y không làm đổi màu quỳ tím ẩm.
(c) 1 mol chất T tác dụng tối đa với 1 mol HCl trong dung dịch.
(d) Ở điều kiện thường, E là chất rắn và dễ tan trong nước.
(đ) Có 2 đồng phân cấu tạo của X thỏa mãn.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
X tác dụng với NaOH thu được 2 muối X có dạng NO3H3N–R–COONH3R’
X: NO3H3N–CH2–COONH3CH3 ; NO3H3N–C2H4–COONH4 ; NO3H3N–CH(CH3)–COONH4
T: H2NCH2COONa; H2NC2H4COONa; H2N–CH(CH3)–COONa và Z: NaNO3
Y: CH3NH2; NH3.
(a) Sai, Z là muối vô cơ.
(b) Sai vì Y làm quỳ tím ẩm hóa xanh.
(c) Sai, 1 mol T tác dụng tối đa 2 mol HCl trong dung dịch. Ví dụ:
H2NCH2COONa + 2HCl ® ClH3NCH2COOH + NaCl
(d) Đúng vì E là amino axit ở điều kiện thường là chất rắn, dễ tan trong nước.
(đ) Sai, có 3 đồng phân của X.
Câu 32:
Cho m gam một mẫu hợp kim Na-K vào 120 ml dung dịch HCl 1M thu được dung dịch Y và 4,032 lít khí H2 (đktc). Thêm m gam bột Al vào Y, sau khi phản ứng kết thúc còn 0,45m gam chất rắn không tan. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
\[{n_{O{H^ - }}}{\rm{ }} = 2{n_{{H_2}}}\] = 0,36 mol và \[{n_{{H^ + }}}\] = 0,12 mol
Þ \[{n_{O{H^ - }}}\] dư = 0,36 – 0,12 = 0,24 mol
Cho Al vào Y có phản ứng giữa Al + OH- + H2O ® AlO2- + 3/2H2
nAl phản ứng = \[{n_{O{H^ - }}}\] dư Þ \[\frac{{m{\rm{ }}--{\rm{ }}0,45m}}{{27}}\] = 0,24 Þ m = 11,78 gam
Câu 33:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Rót vào hai ống nghiệm được đánh số (1) và (2), mỗi ống nghiệm khoảng 3 ml dung dịch AlCl3.
Bước 2: Nhỏ dung dịch NH3 dư vào hai ống nghiệm trên.
Bước 3: Tiếp tục nhỏ dung dịch H2SO4 dư vào ống nghiệm (1) và dung dịch NaOH dư vào ống nghiệm (2), sau đó lắc nhẹ cả hai ống nghiệm.
Cho các phát biểu sau:
(a) Tại bước 2, cả hai ống nghiệm đều xuất hiện kết tủa trắng.
(b) Tại bước 3, ống nghiệm (1) kết tủa tan tạo dung dịch trong suốt.
(c) Tại bước 3, ống nghiệm (2) kết tủa không tan.
(d) Thí nghiệm trên chứng tỏ AlCl3 có tính chất lưỡng tính.
(e) Ở bước 2, nếu thay dung dịch NH3 bằng dung dịch KOH thì hiện tượng vẫn không đổi.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
AlCl3 + 3NH3 + 3H2O ® Al(OH)3 + 3NH4Cl
(1): Al(OH)3 + 3HCl ® AlCl3 + 3H2O
(2): Al(OH)3 + NaOH ® NaAlO2 + 2H2O
(a) Đúng.
(b) Đúng, kết tủa tan tạo dung dịch trong suốt.
(c) Sai, kết tủa tan tạo dung dịch trong suốt.
(d) Sai, AlCl3 không có tính chất lưỡng tính..
(e) Sai, nếu thay NaOH thì ở bước 2 không thu được kết tủa.
Câu 34:
Hỗn hợp X gồm Cu, FeO, Fe2O3, Fe3O4. Hòa tan hết 19,36 gam X trong 148 gam dung dịch HNO3 31,5%, thu được dung dịch Y (chứa các muối của kim loại) và 0,06 mol hỗn hợp khí gồm NO2 và NO. Cho dung dịch NaOH dư vào Y, lọc lấy kết tủa rồi đem nung ngoài không khí đến khối lượng không đổi thu được 20,8 gam rắn. Mặt khác, cô cạn dung dịch Y, thu được chất rắn khan Z. Nung Z đến khối lượng không đổi thấy khối lượng rắn giảm 36,4 gam. Nồng độ phần trăm của Fe(NO3)3 có trong dung dịch Y là
 Xem đáp án
Xem đáp án
Quy đổi hỗn hợp X thành Cu, Fe và O (y mol); \[{n_{HN{O_3}}}\] = 0,74 mol
BT N: \({n_{N{O_3}^ - (Y)}} = {n_{HN{O_3}}} - {n_N} = 0,68\;mol\)
Nung Z:
\({m_{N{O_2}}} + {m_{{O_2}}} = 36,72\) mà theo đề thì lượng khí này là 36,4 nên trong Y có muối Fe2+
Bảo toàn e: \({n_{F{e^{2 + }}}} = \frac{{36,72 - 36,4}}{{32}}.4 = \) 0,04 mol
Dung Y gồm Cu2+ (x mol), Fe2+ (0,04 mol), Fe3+ (z mol), NO3- Þ BTĐT: 2x + 2.0,04 + 3z = 0,68 (1)
Nung kết tủa trong không khí thu được CuO và Fe2O3 Þ 80x + (0,5.0,04 + 0,5z).160 = 20,8 (2)
Từ (1), (2) suy ra x = 0,06 và z = 0,16
Theo mX = 64.0,06 + 16y + 56.(0,04 + 0,16) = 19,36 Þ y = 0,27
Lại có \[\left\{ \begin{array}{l}{n_{N{O_2}}}{\rm{ + }}{{\rm{n}}_{NO}} = 0,06\\BT\;e:0,06.2 + 0,04.2 + 0,16.3 = 2.0,27 + {n_{N{O_2}}} + 3{n_{NO}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{n_{N{O_2}}} = 0,02\\{n_{NO}} = 0,04\end{array} \right.\]
BTKL: mdd Y = 19,36 + 148 – 0,02.46 – 0,04.30 = 165,24 gam
\[\% {m_{Fe{{\left( {N{O_3}} \right)}_3}}} = \frac{{0,16.242}}{{165,24}}.100 = 23,43\% \]
Câu 35:
Thủy phân hoàn toàn m gam hỗn hợp E gồm ba este no, mạch hở là X (đơn chức), Y (hai chức), Z (ba chức) trong dung dịch NaOH đun nóng, thu được 29,8 gam hỗn hợp F gồm một muối cacboxylat đơn chức và một muối cacboxylat hai chức (có cùng số nguyên tử cacbon) và 14,36 gam hỗn hợp T gồm một ancol đơn chức và một ancol hai chức. Cho T tác dụng với CuO dư đun nóng thu được hỗn hợp hơi G và chất rắn giảm 6,4 gam. Cho G tác dụng với AgNO3 trong NH3 dư thu được 116,64 gam Ag. Phần trăm khối lượng của X trong m gam E là
 Xem đáp án
Xem đáp án
Hai ancol trong T có dạng ROH (x mol) và R’(OH)2 (y mol) với m = 14,36g
Cho T tác dụng với CuO, sau phản ứng có m rắn giảm = mO Þ nO = x + 2y = 0,4 (1)
G gồm hai anđehit tác dụng với AgNO3 trong NH3 Þ 4x + 4y = nAg = 1,08 (nếu anđehit nhỏ hơn không phải HCHO thì bài toán vô nghiệm) (2)
Từ (1), (2) suy ra CH3OH (0,14 mol) và R’(OH)2 (0,13 mol) Þ R’ = 42 (C3H6)
Ta có: nCOO = nCOONa = nOH = nNaOH = 0,14 + 0,13.2 = 0,4 mol
\(\left\{ \begin{array}{l}{R_1}COONa:a\;mol\\{R_2}{(COONa)_2}:b\;mol\end{array} \right. \Rightarrow a + 2b = 0,4\) Þ 74,5 < MF < 134
Mà 2 muối có cùng C nên hai muối đó là CH3COONa (0,2 mol) và (COONa)2 (0,1 mol)
Các este lần lượt là CH3COOCH3 (X); (CH3COO)2C3H6 (Y); H3C-OOC-COO-C3H6-OOC-CH3 (Z)
nX + nZ = \[{n_{C{H_3}OH}}\] = 0,14
nY + nZ = \[{n_{{C_3}{H_6}{{\left( {OH} \right)}_2}}}\] = 0,13
nZ = b = 0,1
Þ nX = 0,04 và nY = 0,03 (thỏa mãn số mol gốc muối CH3COO-)
Vậy %mX = 10,51%.v
Câu 36:
Cho các phát biểu sau:
(a) Fructozơ làm mất màu dung dịch nước brom.
(b) Trong phân tử tetrapeptit có ba liên kết peptit.
(c) Hidro hoá hoàn toàn dầu thực vật thu được mỡ động vật.
(d) Phần trăm khối lượng của nitơ trong phân tử xenlulozơ trinitrat là 14,14%.
(đ) Trùng ngưng buta-1,3-đien với acrilonitrin có xúc tác Na được cao su buna-N.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai vì cấu tạo của fructozơ không có thành phần nào có khả năng phản ứng với dung dịch brom.
(b) Đúng.
(c) Sai, hiđro hóa hoàn toàn dầu thực vật thu được bơ.
(d) Đúng, [C6H7O2(ONO2)3]n có %N = 14,14%.
(đ) Sai vì trùng hợp buta- 1,3 đien với acrilonitrin có xúc tác Na được cao su buna-N.
Câu 37:
Hỗn hợp khí X có số mol là 0,4 mol gồm N2 và O2 chứa trong một bình kín, tỉ khối của hỗn hợp Xso với khí H2 là 15,5. Người ta tăng nhiệt độ bình kín đến khoảng 3000oC một thời gian, thu được hỗn hợp khí Y. Cho B hấp thụ hết vào 100 ml dung dịch NaOH 2M, sau phản ứng thấy khối lượng chất tan tăng 3,7 gam. Hiệu suất của phản ứng giữa N2 và O2 là
 Xem đáp án
Xem đáp án
Gọi x, y lần lượt là số mol N2, O2 ; nNaOH = 0,2 mol.
Ta có: x + y = 0,4 và 28x + 32y = 0,4.15,5.2 Þ x = 0,1 ; y = 0,3.
PTHH: N2 + O2 2NO
2NO + O2 ® 2NO2
Ta thấy: y > x ® O2 dư ở cả hai phản ứng. Hiệu suất phản ứng tính theo N2.
PTHH: 2NaOH + 2NO2 ® NaNO3 + NaNO2 + H2O
Chất tan trước phản ứng: Na+, OH- còn chất tan sau phản ứng: Na+, NO2-, NO3- và OH- (có thể dư)
TH1: NaOH hết Þ mtăng = 62.0,5.0,2 + 46.0,5.0,2 – 17.0,2 = 7,4 gam (loại)
TH2: NaOH dư. Gọi a là số mol NO2 bị hấp thụ Þ mtăng = 62.0,5a + 46.0,5a – 17a = 3,7 Þ a = 0,1 mol.
BT N: \[{n_{{N_2}}}\]pư = \(\frac{{0,1}}{2}\) = 0,05 mol Þ \(H = \frac{{0,05}}{{0,1}}.100\% = 50\% \)
Câu 38:
Điện phân hết dung dịch NaCl (điện cực trơ, màng ngăn xốp) thu được dung dịch X. Hấp thụ CO2 dư vào X, thu được dung dịch chất Y. Cho Y tác dụng với Ca(OH)2 theo tỉ lệ mol 1 : 1, tạo ra chất Z tan trong nước. Cho các phát biểu sau:
(a) Trong quá trình điện phân dung dịch NaCl, khối lượng điện cực catot tăng.
(b) Dung dịch X có pH lớn hơn so với dung dịch ban đầu.
(c) Cho chất Z tác dụng với dung dịch HCl có sinh ra chất khí.
(d) Dung dịch chất Y tác dụng dược với dung dịch chất Z.
(đ) Chất Y được sử dụng làm bột nở do dễ phân huỷ thành khí và hơi tạo ra các lỗ xốp trong bánh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
2NaCl + 2H2O 2NaOH + Cl2↑ (anot) + H2↑ (catot)
CO2 (dư) + NaOH → NaHCO3 (Y)
NaHCO3 + Ca(OH)2 → CaCO3↓ + NaOH (Z) + H2O.
(a) Sai, H2O điện phân tại catot tạo khí H2 nên khối lượng catot không đổi.
(b) Đúng. pH của dung dịch sau phản ứng lớn hơn 7 và tăng so với dung dịch ban đầu (pH = 7).
(c) Sai, Z tác dụng với HCl không sinh ra khí.
(d) Đúng, NaHCO3 + NaOH ® Na2CO3 + H2O.
(đ) Đúng, NaHCO3 có ứng dụng làm bột nở.
Câu 39:
Hòa tan 2,80 gam một loại quặng sắt (E) trong dung dịch H2SO4 loãng, thu được dung dịch X (gồm các hợp chất của sắt) và chất rắn Y (không chứa nguyên tố sắt). Cho kim loại Cu tan vào X, thu được dung dịch Z chứa hai muối rồi pha loãng Z thu được dung dịch T. Cho T phản ứng vừa đủ với 20,00 ml dung dịch KMnO4 0,05M trong dung dịch H2SO4. Phần trăm khối lượng nguyên tố sắt có trong quặng sắt (E) là
 Xem đáp án
Xem đáp án
Cho Cu vào X thu được Z chứa 2 muối là CuSO4 và FeSO4 nên X gồm Fe2(SO4)3, FeSO4
Bảo toàn e: \[{n_{FeS{O_4}}} = {\rm{ }}5{n_{KMn{O_4}}}\] = 5.10-3 mol
Bảo toàn Fe: nFe (E) = \[{n_{FeS{O_4}}}\] = 5.10-3 mol Þ \[\% {m_{Fe}} = \frac{{{{5.10}^{ - 3}}.56}}{{2,80}}.100 = 10\% \]
Câu 40:
TNT-13 (là tên thương mại của 2,4,6-trinitrotoluen) được biết đến là một chất nổ mạnh với các đặc tính thuận tiện và chủ yếu được sử dụng trong lĩnh vực quân sự. Để sản xuất ra 2500 bao thuốc nổ TNT cần tối thiểu m tấn toluen. Biết 1 bao thuốc nổ TNT có khối lượng 40 kg và hiệu suất phản ứng tính theo toluen là 70%. Giá trị của m là
|
TRINITROTOLUEN TNT-INDUSTRIAL C6H2(NO2)3CH3 Khối lượng: 40 kg |
 Xem đáp án
Xem đáp án
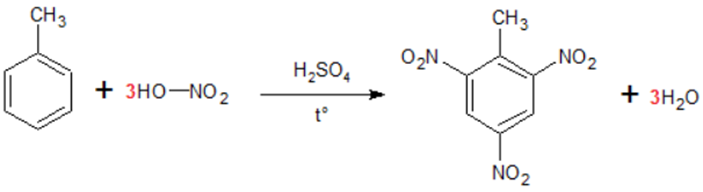
Số mol C6H2(NO2)3CH3 = \(\frac{{40}}{{227}}\;kmol \Rightarrow {m_{{C_7}{H_8}}} = \frac{{40}}{{227}}.\frac{{100}}{{70\% }}.92 = 23,16\;kg\)
Để có được 2500 bao thuốc nổ TNT thì cần 23,16.2500 = 57898 kg = 57,898 tấn toluen
