(2023) Đề thi thử Hóa học THPT Nguyễn Khuyến- Lê Thánh Tông, Hồ Chí Minh có đáp án
(2023) Đề thi thử Hóa học THPT Nguyễn Khuyến- Lê Thánh Tông, Hồ Chí Minh có đáp án
-
1370 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 2:
Hòa tan 5,4 gam Al vào dung dịch HCl dư thu được V lít khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
2Al + 6HCl → 2AlCl3 + 3H2
nAl = 0,2 → nH2 = 0,3 → V = 6,72 lít
Câu 4:
Cho phản ứng hóa học sau: CH3CH=O + H2 → X. Chất X là
 Xem đáp án
Xem đáp án
Chất X là CH3CH2OH:
CH3CH=O + H2 → CH3CH2OH
Câu 6:
Kim loại Al tác dụng với chất nào sau đây gọi là phản ứng nhiệt nhôm?
 Xem đáp án
Xem đáp án
Phản ứng của Al với oxit kim loại đứng sau Al gọi là phản ứng nhiệt nhôm.
→ Al + Fe2O3 là phản ứng nhiệt nhôm.
Câu 12:
Kim loại loại X tan trong dung dịch HCl nhưng không tan trong dung dịch NaOH. Kim loại X là
 Xem đáp án
Xem đáp án
Kim loại X là Mg. Còn lại Ba, Al tan trong cả dung dịch HCl và NaOH; Cu không tan trong HCl, không tan trong NaOH.
Câu 13:
Trong dãy các ion sau: Fe2+, Na+, Cu2+, Ag+. Cation có tính oxi hóa mạnh nhất là
 Xem đáp án
Xem đáp án
Chọn C
Câu 14:
Chất nào sau đây không tác dụng với dung dịch NaOH?
 Xem đáp án
Xem đáp án
CaCl2 không phản ứng với dung dịch NaOH.
FeCl3 + NaOH → Fe(OH)3 + NaCl
NaHSO4 + NaOH → Na2SO4 + H2O
Al(OH)3 + NaOH → NaAlO2 + H2O
Câu 17:
Chất nào sau đây thuộc loại amin bậc ba?
 Xem đáp án
Xem đáp án
Amin bậc 3 được tạo ra khi thay thế 3H trong NH3 bằng 3 gốc hiđrocacbon → (CH3)3N là amin bậc 3.
Câu 20:
Đốt cháy 2,15 gam hỗn hợp gồm Zn, Al và Mg trong khí oxi dư, thu được 3,43 gam hỗn hợp X. Toàn bộ X phản ứng vừa đủ với V ml dung dịch HCl 0,5M. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
 Xem đáp án
Xem đáp án
nO = (3,43 – 2,15)/16 = 0,08
→ nH2O = 0,08
→ nHCl = 2nH2O = 0,16
→ V = 320 ml
Câu 22:
Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch sau: HNO3, Na2SO4, Ba(OH)2, NaHSO4. Số trường hợp có phản ứng xảy ra là
 Xem đáp án
Xem đáp án
Tất cả đều phản ứng với Ba(HCO3)2:
Ba(HCO3)2 + HNO3 → Ba(NO3)2 + CO2 + H2O
Ba(HCO3)2 + Na2SO4 → BaSO4 + NaHCO3
Ba(HCO3)2 + Ba(OH)2 → BaCO3 + H2O
Ba(HCO3)2 + NaHSO4 → BaSO4 + Na2SO4 + CO2 + H2O
Câu 23:
Phương pháp nào sau đây không thể làm mềm nước cứng toàn phần?
 Xem đáp án
Xem đáp án
Dùng dung dịch HCl dư không thể làm mềm nước cứng toàn phần do không loại bỏ được ion Mg2+, Ca2+.
Câu 24:
Cho phương trình phản ứng sau: Mg + Cu2+ → Mg2+ + Cu. Nhận xét nào về phản ứng trên là đúng?
 Xem đáp án
Xem đáp án
Mg là chất khử (vì số oxi hóa của Mg tăng từ 0 lên +2), Cu2+ là chất oxi hóa (vì số oxi hóa của Cu2+ giảm từ +2 xuống 0)
Câu 25:
Thực hiện phản ứng este hóa giữa axit oxalic với ancol đơn chức X, thu được hỗn hợp gồm hai sản phẩm hữu cơ Y và Z (MY < MZ). Biết rằng trong Y, oxi chiếm 54,24% về khối lượng. Công thức của X là
 Xem đáp án
Xem đáp án
MY < MZ nên Y là HOOC-COOA và Z là (COOA)2
MY = A + 89 = 16.4/54,24% → A = 29: -C2H5
X là C2H5OH
Câu 26:
Cho 2,8 gam bột Fe vào 200 ml dung dịch X gồm CuCl2 0,2 M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Fe + CuCl2 → FeCl2 + Cu
nFe = 0,05; nCuCl2 = 0,04 → Chất rắn gồm Cu (0,04) và Fe dư (0,01)
m rắn = 3,12 gam
Câu 27:
Thí nghiệm nào sau đây không xảy ra phản ứng hóa học?
 Xem đáp án
Xem đáp án
A. Fe + Fe(NO3)3 → Fe(NO3)2
B. Cu + H+ + NO3- → Cu2+ + NO + H2O
C. Al + Cl2 → AlCl3
D. Không phản ứng
Câu 28:
Amino axit X trong phân tử có một nhóm –NH2 và một nhóm –COOH. Cho 26,7 gam X phản ứng với lượng dư dung dịch HCl, thu được dung dịch chứa 37,65 gam muối. Công thức của X là
 Xem đáp án
Xem đáp án
nHCl = (m muối – mX)/36,5 = 0,3 → nX = 0,3
→ MX = 89: X là H2N-[CH2]2-COOH.
Câu 29:
Đốt cháy hoàn toàn m gam hỗn hợp gồm xenlulozơ, tinh bột và saccarozơ, thu được (m + 3,9) gam CO2 và (m – 2,88) gam H2O. Giá trị của m là
 Xem đáp án
Xem đáp án
Các chất dạng Cn(H2O)m nên: m = mC + mH2O
⇔ m = 12(m + 3,9)/44 + m – 2,88 → m = 6,66 gam
Câu 30:
Cho hỗn hợp gồm Cu và Fe3O4 vào dung dịch H2SO4 loãng dư. Sau khi phản ứng xảy ra hoàn toàn, thu được chất rắn X và dung dịch Y. Chất tan trong dung dịch Y là
 Xem đáp án
Xem đáp án
Cu + Fe3O4 + 4H2SO4 → CuSO4 + 3FeSO4 + 4H2O
Chất rắn X là Cu dư, Y chứa FeSO4, CuSO4, H2SO4.
Câu 31:
Hòa tan hoàn toàn m (gam) hỗn hợp rắn gồm FeS, FeS2, CuS, Cu2S trong dung dịch HNO3 đặc, nóng thu được dung dịch X chỉ chứa hai muối sunfat và 40,32 lít khí NO2 (sản phẩm khử duy nhất, đktc). Cho dung dịch Ba(OH)2 dư vào dung dịch X thu được 70,475 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Quy đổi hỗn hợp thành Fe (a), Cu (b) và S (c)
→ X chứa Fe3+ (a), Cu2+ (b) và SO42- (c)
Bảo toàn điện tích: 3a + 2b = 2c
Bảo toàn electron: 3a + 2b + 6c = 1,8
m↓ = 107a + 98b + 233c = 70,475
→ a = 0,1; b = 0,075; c = 0,225
→ m = 17,6
Câu 32:
Một loại phân bón NPK có tỉ lệ dinh dưỡng ghi trên bao bì là 20 – 20 – 15. Mỗi hecta đất trồng ngô, người nông dân cần cung cấp 150kg N, 60kg P2O5 và 110kg K2O. Người nông dân sử dụng đồng thời phân bón NPK (20-20-15), phân kali (độ dinh dưỡng 60%) và ure (độ dinh dưỡng 46%). Biết giá thành mỗi kg phân NPK, phân kali, phân ure lần lượt là 14,000 VNĐ, 18,000 VNĐ và 20,000 VNĐ. Tổng số tiền mà người nông dân cần mua phân cho một hecta ngô là
 Xem đáp án
Xem đáp án
m phân NPK = a kg
m phân kali = b kg
m phân urê = c kg
mN = 20%a + 46%c = 150
mP2O5 = 20%a = 60
mK2O = 15%a + 60%b = 110
→ a = 300; b = 325/3; c = 4500/23
Số tiền = 14000a + 18000b + 20000c = 10063043 VNĐ
Câu 33:
Hấp thụ hết 13,44 lít khí CO2 (đktc) vào dung dịch chứa x mol Ba(OH)2 và x mol NaOH, thu được m gam chất rắn. Mặt khác, hấp thụ hết 13,44 lít khí CO2 (đktc) vào dung dịch chứa x mol Ba(OH)2, thu được 0,5m gam chất rắn. Giá trị của x là
 Xem đáp án
Xem đáp án
nCO2 = 0,6; nBaCO3 = m/197 = y
TN2: 0,6 mol CO2 + x mol Ba(OH)2 → 0,5y mol BaCO3 + (x – 0,5y) mol Ba(HCO3)2
Bảo toàn C → 0,6 = 0,5y + 2(x – 0,5y) (1)
TN1: 0,6 mol CO2 + x mol Ba(OH)2 + x mol NaOH:
• Nếu BaCO3 chưa bị hòa tan → x = y (2)
(1)(2) → x = y = 0,4
• Nếu BaCO3 đã bị hòa tan → Các sản phẩm là BaCO3 (y), NaHCO3 (x), Ba(HCO3)2 (x – y)
Bảo toàn C → 0,6 = y + x + 2(x – y) (3)
(1)(3) → Vô nghiệm.
Câu 34:
Cho sơ đồ phản ứng sau:
(1) X + Y → Al(OH)3↓ + Z.
(2) X + T → Z + AlCl3.
(3) AlCl3 + Y → Al(OH)3↓ + T.
Các chất X, Y, Z và T tương ứng là
 Xem đáp án
Xem đáp án
(3) → T chứa Cl (Loại A, D) → T là BaCl2 → Y là Ba(OH)2
→ Chọn B:
(1) Al2(SO4)3 + Ba(OH)2 → Al(OH)3↓ + BaSO4.
(2) Al2(SO4)3 + BaCl2 → BaSO4 + AlCl3.
(3) AlCl3 + Ba(OH)2 → Al(OH)3↓ + BaCl2.
Câu 35:
Điện phân dung dịch chứa x mol CuSO4, y mol H2SO4 và z mol NaCl (với điện cực trơ, màng ngăn xốp, hiệu suất điện phân là 100%, cường độ dòng điện 2,5A). Thời gian điện phân và khối lượng Al2O3 bị hoà tan tối đa trong dung dịch sau điện phân ứng với đồ thị sau:
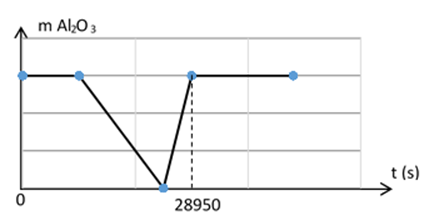
Biết tại thời điểm 28950 (s) khối lượng dung dịch điện phân giảm 35,125 gam. Giá trị (x + y + z) là
 Xem đáp án
Xem đáp án
Đoạn 1: CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
nCl2 = nCu = x
Đoạn 2: H2SO4 + 2NaCl → H2 + Cl2 + Na2SO4
nCl2 = nH2 = y
Đoạn 3: 2H2O + 2NaCl → H2 + Cl2 + 2NaOH
nH2 = nCl2 = 0,5z – x – y
Đoạn 4: Điện phân nước ở 2 điện cực, tạo H2, O2.
Lúc t = 28950 → ne = 0,75 → z = 0,75
Lượng Al2O3 bị hòa tan bởi H+ và bởi OH- như nhau nên: nH+ = 6nAl2O3; nOH- = 2nAl2O3 → nH+ = 3nOH-
⇔ 2y = 3.2(0,5z – x – y) (1)
m giảm = 64x + 2(0,75 – 2x)/2 + 35,5z = 35,125 (2)
(1)(2) → x = 0,125; y = 0,1875
→ x + y + z = 1,0625
Câu 36:
Cho các phát biểu sau:
(a) C6H5NH2 có tên thay thế là anilin.
(b) Xenlulozơ không tan trong nước nhưng tan nhiều trong dung môi hữu cơ như etanol, ete, benzen.
(c) Trong môi trường axit, fructozơ chuyển thành glucozơ.
(d) Ở điều kiện thường, etyl axetat là chất lỏng, tan nhiều trong nước.
(e) Tơ nitron thuộc loại tơ poliamit.
(g) Công thức phân tử của Glu-Ala-Lys có 4 nguyên tử nitơ và 6 nguyên tử oxi.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, tùy cấu tạo của C6H5-, nếu C6H5- là phenyl thì C6H5NH2 có tên thay thế là benzenamin.
(b) Sai, xenlulozơ không tan trong nước và không tan trong dung môi hữu cơ như etanol, ete, benzen.
(c) Sai, trong môi trường kiềm fructozơ chuyển thành glucozơ trong 1 cân bằng.
(e) Sai, tơ nitron không có nhóm amit.
(g) Đúng, số N = 1 + 1 + 2 = 4 và số O = 4 + 2 + 2 – 2 = 6
Câu 37:
Đốt cháy hoàn toàn 15,48 gam hỗn hợp Q gồm ba este X, Y, Z (MX < MY < MZ < 200 đvC) thu được 0,64 mol CO2 và 0,38 mol H2O. Mặt khác, xà phòng hoá hoàn toàn 15,48 gam X với dung dịch NaOH (vừa đủ), thu được 5,64 gam hỗn hợp E gồm hai ancol (tỉ lệ mol 1 : 3) và dung dịch chứa 19,52 gam hỗn hợp F gồm ba muối. Đốt cháy hoàn toàn F thu được Na2CO3, H2O và 14,52 gam CO2. Phần trăm số mol của Z trong hỗn hợp Q gần nhất là
 Xem đáp án
Xem đáp án
nCOO-Ancol = u và nCOO-phenol = v
mQ = 16(2u + 2v) + 0,64.12 + 0,38.2 = 15,48
nNaOH = u + 2v; nH2O = v, bảo toàn khối lượng:
15,48 + 40(u + 2v) = 5,64 + 19,52 + 18v
→ u = 0,18; v = 0,04
nNaOH = 0,26 → nNa2CO3 = 0,13
→ nC(muối) = nNa2CO3 + nCO2 = 0,46
→ nC(Ancol) = 0,64 – 0,46 = 0,18
nO(Ancol) = u = 0,18 → nH(Ancol) = 0,6
nAncol = nH/2 – nC = 0,12
Số C = 0,18/0,12 = 1,5 → Có CH3OH
MX < MY < MZ < 200 đvC nên ancol không quá 3 chức, mặt khác ancol có nC = nO nên:
TH1: CH3OH (0,06) và C2H4(OH)2 (0,06) (Bấm hệ nAncol, mAncol): Loại vì không đúng tỉ lệ 1 : 3.
TH2: CH3OH (0,09) và C3H5(OH)2 (0,03) (Bấm hệ nAncol, mAncol): Thỏa mãn tỉ lệ 1 : 3.
Muối chứa COONa (u + v = 0,22); ONa (0,04); C (0,46 – 0,22 = 0,24) và H (0,34 – Tính từ mF)
Dễ thấy nC = 6nONa nên muối gồm C6H5ONa (0,04), HCOONa (0,34 – 0,04.5 = 0,14) và (COONa)2 (0,04)
Q gồm:
Y là (HCOO)3C3H5: 0,03
Z là C6H5-OOC-COO-CH3: 0,04
X là HCOOCH3: 0,05
→ %nZ = 33,33%
Câu 38:
Đốt cháy hoàn toàn 0,12 mol hỗn hợp P gồm axit linoleic, tripanmitin, trieste X cần dùng 7,03 mol O2 thu được hỗn hợp gồm 4,98 mol CO2 và 4,74 mol H2O. Mặt khác, m gam P tác dụng vừa đủ với dung dịch NaOH thu được hỗn hợp Y gồm ba muối C17H31COONa, C15H31COONa, RCOONa có tỉ lệ mol tương ứng là 1 : 13 : 2. Biết số mol trieste X lớn hơn số mol axit linoleic, tính phần trăm khối lượng của X trong P gần nhất là
 Xem đáp án
Xem đáp án
P gồm axit linoleic (u mol), tripanmitin, trieste X (tổng v mol)
→ nP = u + v = 0,12
Bảo toàn O → 2u + 6v + 7,03.2 = 4,98.2 + 4,74
→ u = 0,02; v = 0,1
→ n muối = u + 3v = 0,32
→ Y gồm C17H31COONa (0,02), C15H31COONa (0,26), RCOONa (0,04)
nX > 0,02 → nX = nRCOONa = 0,04
P gồm C17H31COOH (0,02), (RCOO)(C15H31COO)2A (0,04) và (C15H31COO)3C3H5 (0,06)
Bảo toàn khối lượng → mP = 79,48
mX = mP – mC17H31COOH – m(C15H31COO)3C3H5 = 25,52
→ %X = 32,11%
Câu 39:
Thực hiện phản ứng nhiệt nhôm hoàn toàn 24,66 gam hỗn hợp T gồm Al, Fe3O4 và Fe2O3 thu được hỗn hợp X. Chia X làm 2 phần bằng nhau:
Phần 1: Cho phản ứng hết với dung dịch NaOH dư thấy có 0,15 mol NaOH phản ứng, đồng thời có 1,68 lít khí (đktc) thoát ra.
Phần 2: Trộn với m gam KNO3, rồi hoà tan vào 100 gam dung dịch HCl, sau phản ứng thu được dung dịch Y chỉ chứa các muối và hỗn hợp khí Z gồm NO (0,09 mol) và H2 (0,02 mol). Dung dịch Y tác dụng với lượng dư dung dịch AgNO3 thu được 125,755 gam kết tủa. Nồng độ phần trăm dung dịch FeCl3 có trong Y gần nhất với giá trị là
 Xem đáp án
Xem đáp án
Mỗi phần X nặng 12,33 gam
Phần 1: nAl ban đầu = nNaOH = 0,15
nH2 = 0,075 → nAl dư = 0,05 → nAl phản ứng = 0,1 → nO = 0,15 → nFe = 0,105
Phần 2: Quy đổi thành Al (0,15), Fe (0,105), O (0,15)
Z chứa Al3+ (0,15), Fe2+ (a), Fe3+ (b), NH4+ (c), K+ (c + 0,09) và Cl- (2a + 3b + 2c + 0,54)
Bảo toàn Fe → a + b = 0,105
m↓ = 143,5(2a + 3b + 2c + 0,54) + 108a = 125,755
nH+ = 2a + 3b + 2c + 0,54 = 10c + 0,09.4 + 0,02.2 + 0,15.2
→ a = 0,035; b = 0,07; c = 0,015
mddY = mKNO3 + mPhần 2 + mddHCl – mZ = 120,195
C%FeCl3 = 162,5b/120,195 = 9,46%
Câu 40:
Cho các hỗn hợp (với tỉ lệ mol tương ứng) vào nước dư như sau:
(a) Al và Ca (3 : 2).
(b) Fe2(SO4)3 và Cu (1 : 1).
(c) Na2O và Ca(H2PO4)2 (1 : 1).
(d) BaO và Na2SO4 (1 : 1).
(đ) BaCl2 và NaHCO3 (1 : 1).
Sau khi kết thúc phản ứng hoàn toàn, số thí nghiệm tạo thành dung dịch đồng nhất (không có rắn) là
 Xem đáp án
Xem đáp án
(a) Ca + 2H2O → Ca(OH)2 + H2
Ca(OH)2 + 2Al + 2H2O → Ca(AlO2)2 + 3H2
Ca(OH)2 còn dư, Al tan hết.
(b) Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
(c) Na2O + H2O → 2NaOH
Ca(H2PO4)2 + 2NaOH → CaHPO4↓ + Na2HPO4 + 2H2O
(d) BaO + H2O + Na2SO4 → BaSO4↓ + 2NaOH
(đ) Không phản ứng.
