(2023) Đề thi thử Hóa học THPT Chuyên Đại học Khoa học tự nhiên (Lần 2) có đáp án
(2023) Đề thi thử Hóa học THPT Chuyên Đại học Khoa học tự nhiên (Lần 2) có đáp án
-
1178 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 5:
Điện phân (với các điện cực trơ) NaOH nóng chảy, sản phẩm thu được tại anot là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 11:
Trứng cá khi ướp với muối, thu được món trứng cá muối ở dạng rắn. Cơ sở của phương pháp này dựa vào tính chất nào của protein?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 15:
Chất nào sau đây tác dụng với dung dịch H2SO4 loãng, thu được Fe2(SO4)3?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 21:
Cho dãy các polime sau: poliacrilonitrin, poli (vinyl clorua), poli (hexametylen adipamit), poli (metyl metacrylat). Số polime được tổng hợp từ phản ứng trùng hợp là
 Xem đáp án
Xem đáp án
Các polime được tổng hợp từ phản ứng trùng hợp là:
poliacrilonitrin (từ CH2=CH-CN), poli (vinyl clorua) (từ CH2=CH-Cl), poli (metyl metacrylat) (từ CH2=C(CH3)COOCH3)
Câu 22:
Cho 9 gam etylamin tác dụng hết với HCl, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
C2H5NH2 + HCl → C2H5NH3Cl
nC2H5NH3Cl = nC2H5NH2 = 0,2 → m = 16,3 gam
Câu 23:
Cho m gam bột Al vào 150 ml dung dịch CuSO4 0,2M, sau phản ứng hoàn toàn thu được 2m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
nCuSO4 = 0,03
Nếu CuSO4 dư thì mCu/mAl = 3.64/2.27 = 3,56 ≠ 2, trái với giả thiết. Vậy CuSO4 hết → nAl2(SO4)3 = 0,01
Bảo toàn khối lượng:
m + 0,03.160 = 0,01.342 + 2m → m = 1,38 gam
Câu 25:
Cho hỗn hợp X gồm Al và Cu tác dụng với dung dịch chứa AgNO3 và Fe(NO3)3, sau phản ứng hoàn toàn thu được chất rắn Y. Cho Y tác dụng với dung dịch HCl dư, thu được dung dịch T chứa hai chất tan. Thành phần chất rắn Y gồm
 Xem đáp án
Xem đáp án
Y + HCl dư tạo dung dịch T chứa hai chất tan → Y chứa Fe, Cu, Ag. Hai chất tan trong T là FeCl2 và HCl dư.
Câu 26:
Hòa tan vừa hết m gam hỗn hợp X gồm Mg và Al trong V1 lít dung dịch HCl 2M và H2SO4 1M, thu được khí hiđro. Mặt khác, hòa tan vừa hết m gam X cần dùng V2 lít dung dịch HNO3 4M, thu được khí NO (sản phẩm khử duy nhất của N+5). Tỉ số V1 : V2 là
 Xem đáp án
Xem đáp án
nHCl = 2V1, nH2SO4 = V1 → nH2 = 2V1
nHNO3 = 4V2 → nNO = nHNO3/4 = V2
Bảo toàn electron: 2nH2 = 3nNO
⇔ 2.2V1 = 3V2 → V1 : V2 = 3 : 4
Câu 27:
Cho hỗn hợp X gồm Fe và Cu, tác dụng với O2, thu được m gam chất rắn Y. Cho Y tác dụng với 200 ml dung dịch HNO3 4M, thu được 2,24 lít khí NO (sản phẩm khử duy nhất) và 11 gam chất rắn Z. Cho Z tác dụng với dung dịch HCl, thu được khí H2. Giá trị của m là
 Xem đáp án
Xem đáp án
nHNO3 = 0,8; nNO = 0,1
nH+ = 4nNO + 2nO → nO = 0,2
Z + HCl tạo H2 nên Z chứa Cu, Fe dư → Y + HNO3 chỉ tạo muối Fe(NO3)2.
Bảo toàn N → nFe(NO3)2 = (0,8 – 0,1)/2 = 0,35
→ mY = 0,35.56 + 11 + 0,2.16 = 33,8 gam
Câu 28:
Để tráng một số lượng gương soi có diện tích bề mặt 0,35 m² với độ dày 0,1 μm người ta đun nóng dung dịch chứa 30,6 gam glucozơ với một lượng dung dịch bạc nitrat trong amoniac. Biết khối lượng riêng của bạc là 10,49 g/cm³, hiệu suất phản ứng tráng gương là 80% (tính theo glucozơ). Số lượng gương soi tối đa sản xuất được là
 Xem đáp án
Xem đáp án
mAg = 108.2.80%.30,6/180 = 29,376 gam
→ V Ag = 29,376/10,49 = 2,8 cm³
Mỗi tấm gương cần tráng lượng Ag có thể tích là 0,35.10000.0,1.10-4 = 0,035 cm³
→ Số lượng gương soi = 2,8/0,035 = 80 tấm
Câu 29:
Nung 20 gam quặng đolomit (thành phần chính là CaCO3.MgCO3) và các tạp chất trơ ở nhiệt độ cao đến phản ứng hoàn toàn, thu được 4,48 lít khí CO2. Thành phần % của CaCO3.MgCO3 trong quặng đolomit là
 Xem đáp án
Xem đáp án
CaCO3.MgCO3 → CaO + MgO + 2CO2
nCO2 = 0,2 → nCaCO3.MgCO3 = 0,1
→ %CaCO3.MgCO3 = 0,1.184/2 = 92%
Câu 30:
Cho các phát biểu sau:
(a) Sục khí NH3 dư vào dung dịch AlCl3, thu được kết tủa.
(b) Phân lân cung cấp nguyên tố nitơ cho cây trồng và đất trồng.
(c) Cho miếng gang (hợp kim Fe-C) vào dung dịch HCl, có xảy ra ăn mòn điện hóa.
(d) Các phản ứng của kim loại với lưu huỳnh đều xảy ra ở nhiệt độ cao.
(e) Thạch cao nung (CaSO4.H2O) được sử dụng để đúc tượng, bó bột, làm trần nhà.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng: NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl
(b) Sai, phân lân cung cấp nguyên tố photpho.
(c) Đúng
(d) Sai, Hg + S xảy ra ở nhiệt độ thường.
(e) Đúng.
Câu 31:
Cho các phát biểu sau:
(a) So với các ankan có cùng số nguyên tử cacbon, các anken thường có số đồng phân lớn hơn.
(b) Khả năng phản ứng thế hiđro trong vòng benzen của anilin cao hơn so với benzen.
(c) Thủy phân hoàn toàn xenlulozơ thu được glucozơ.
(d) Trùng hợp vinyl xianua thu được tơ nitron.
(e) Phản ứng thủy phân este trong môi trường axit là phản ứng một chiều.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, ankan chỉ có đồng phân mạch C, anken ngoài đồng phân mạch C còn có đồng phân vị trí C=C và có thể có đồng phân hình học.
(b) Đúng, vì anilin có nhóm -NH2 đẩy electron làm hoạt hóa vòng benzen.
(c) Đúng: (C6H10O5)n + nH2O → nC6H12O6
(d) Đúng: nCH2=CH-CN → (-CH2-CH(CN)-)n
(e) Sai, hầu hết phản ứng thủy phân este trong môi trường axit là phản ứng thuận nghịch.
Câu 32:
Thủy phân hoàn toàn hỗn hợp etyl propionat và etyl fomat trong dung dịch NaOH, thu được sản phẩm gồm:
 Xem đáp án
Xem đáp án
C2H5COOC2H5 + NaOH → C2H5COONa + C2H5OH
HCOOC2H5 + NaOH → HCOONa + C2H5OH
→ Sản phẩm thu được gồm 2 muối và 1 ancol.
Câu 33:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho nhúm bông vào ống nghiệm chứa khoảng 4 ml dung dịch H2SO4 70%. Khuấy đều hỗn hợp bằng đũa thủy tinh.
Bước 2: Đặt ống nghiệm vào nồi nước sôi cho đến khi thu được dung dịch đồng nhất. Để nguội sau đó cho dung dịch NaOH 10% vào đến môi trường kiềm.
Bước 3: Cho khoảng 1 ml dung dịch CuSO4 5% vào ống nghiệm sau bước 2.
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
A. Đúng, dung dịch sau bước 2 chứa glucozơ nên có tráng gương.
B. Đúng, glucozơ có nhiều OH kề nhau nên tạo phức xanh lam với Cu(OH)2.
C. Đúng, trong môi trường kiềm glucozơ và fructozơ chuyển hóa qua lại lẫn nhau.
D. Sai, H2SO4 đặc háo nước mạnh nên sẽ làm xenlulozơ hóa than đen.
Câu 34:
Hỗn hợp E gồm ba este mạch hở X, Y, Z, trong đó có hai este đơn chức và một este hai chức (MX < MY < MZ). Đốt cháy hoàn toàn m gam E, thu được 0,86 mol CO2. Cho m gam E tác dụng vừa đủ với dung dịch NaOH, thu được 8,08 gam hỗn hợp T gồm các ancol no và 21,08 gam hỗn hợp muối của hai axit cacboxylic kế tiếp trong dãy đồng đẳng. Cho toàn bộ T tác dụng với Na dư, thu được 2,688 lít H2 (đktc). Khối lượng của Y trong m gam E là:
 Xem đáp án
Xem đáp án
nH2 = 0,12 → nO(T) = 2nH2 = 0,24
n muối = 0,24 → M muối = 87,83
→ CH3COONa (0,14) và C2H5COONa (0,1)
Bảo toàn C → nC(T) = 0,28
→ nH(T) = (mT – mC – mO)/1 = 0,88
→ nT = nH/2 – nC = 0,16
→ T gồm ancol đơn (0,08) và ancol đôi (0,08) (Bấm hệ nT và nO(T) để tính số mol)
E gồm:
(CH3COO)(C2H5COO)R: 0,08 mol
CH3COOA: 0,14 – 0,08 = 0,06 mol
C2H5COOB: 0,1 – 0,08 = 0,02 mol
nC(T) = 0,08CR + 0,06CA + 0,02CB = 0,28
→ 4CR + 3CA + CB = 14
CR ≥ 2 → CR = 2, CA = 1, CB = 3 là nghiệm duy nhất
X là CH3COOCH3: 0,06 mol
Y là C2H5COOC3H7: 0,02 mol → mY = 2,32 gam
Z là (CH3COO)(C2H5COO)C2H4: 0,08 mol
Câu 35:
Thực hiện phản ứng este hoá giữa amino axit X (H2NCxHy(COOH)2) với etanol trong HCl khan, thu được sản phẩm Z (Z không chứa nhóm -COOH và nhóm -NH2). Trong phân tử Z, oxi chiếm 28,38% theo khối lượng. Thủy phân hoàn toàn một lượng Z trong trong dung dịch NaOH dư đun nóng, thu được 9,2 gam etanol và m gam hỗn hợp muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Z là ClH3N-R(COOC2H5)2
MZ = R + 198,5 = 16.4/28,38% → R = 27
nC2H5OH = 0,2 → Muối gồm NaCl (0,1) và H2N-R(COONa)2 (0,1)
→ m muối = 23,55 gam
Câu 36:
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, Ba, Na2O, BaO trong nước, thu được 3,36 lít khí H2 và dung dịch Y. Hấp thụ khí CO2 vào Y. Khối lượng chất tan trong dung dịch phụ thuộc vào lượng CO2 hấp thụ như sau:
|
Lượng CO2 bị hấp thụ (mol) |
0,1 |
0,2 |
0,3 |
|
Khối lượng chất tan (gam) |
16,55 |
9,30 |
13,70 |
Giá trị của m là
 Xem đáp án
Xem đáp án
Gọi các thời điểm dùng 0,1 – 0,2 – 0,3 mol CO2 là (1), (2), (3).
Lượng CO2 từ (1) sang (2) tăng nhưng chất tan giảm nên tại (1) Ba(OH)2 vẫn chưa kết tủa hết.
Nếu tại (2) Ba(OH)2 cũng chưa kết tủa hết thì:
m chất tan giảm = mBa(OH)2 phản ứng từ (1) sang (2) = 0,1.171 > 16,55 – 9,3: Vô lý. Vậy tại (2) Ba(OH)2 đã hết.
Tại (1): nBaCO3 = 0,1; nBa(OH)2 = x và nNaOH = y
→ 171x + 40y = 16,55
Giả sử tại (2) NaOH chưa hết
Từ (1) sang (2): nBaCO3 = x; nNa2CO3 = 0,1 – x
→ 16,55 – 171x – 40.2(0,1 – x) + 106(0,1 – x) = 9,3
→ x = 0,05; y = 0,2
Tại (2) chất tan đang có Na2CO3 (0,05) và NaOH (0,1)
Thêm 0,1 mol CO2 thì tại (3) có Na2CO3 (0,05) và NaHCO3 (0,1) → m chất tan = 13,7: Thỏa mãn, điều giả sử là đúng.
Quy đổi X thành Na (0,2), Ba (0,15) và O
Bảo toàn electron: nNa + 2nBa = 2nO + 2nH2
→ nO = 0,1
→ m = 26,75
Câu 37:
Hàn nhiệt là phương pháp hàn dựa trên cơ sở của phản ứng tỏa nhiệt giữa một oxit kim loại với một kim loại khác có ái lực hóa học với oxi mạnh hơn. Thông dụng nhất là phản ứng giữa nhôm và oxit sắt từ (Fe3O4).
Phản ứng xảy ra khi nung nóng một lượng nhỏ hỗn hợp đến nhiệt độ khoảng 1200 - 1300°C, sau đó phản ứng tiếp tục được duy trì nhờ nhiệt độ của phản ứng và lan nhanh ra toàn khối hỗn hợp làm nhiệt độ tăng lên đến 3000°C, nung nóng chảy sắt tạo thành thép lỏng và làm nóng chảy các tạp chất tạo thành xỉ lỏng.
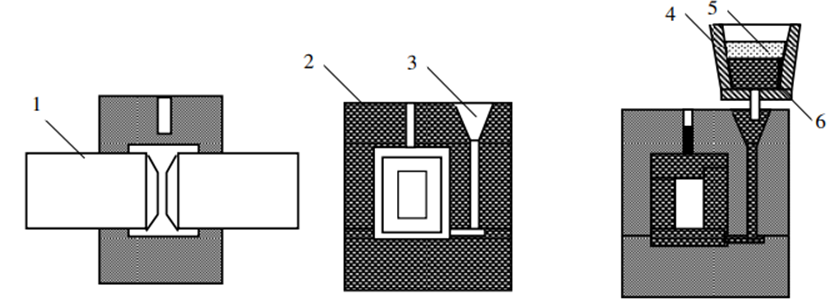
Tiến hành mở lỗ rót ở đáy nồi phản ứng để rót thép lỏng vào khuôn. Thép lỏng có nhiệt độ cao nung chảy mép hàn, sau đó đông đặc tạo thành mối hàn. Cho biết khối lượng riêng của sắt là 7,87 g/cm³ và lượng sắt trong mối hàn bằng 90% lượng sắt được điều chế ra và các chất được lấy đúng theo hệ số tỉ lượng. Khối lượng gần nhất của hỗn hợp tecmit cần lấy để có thể hàn được vết nứt gãy của đường ray có thể tích là 10 cm³ là
 Xem đáp án
Xem đáp án
nFe điều chế ra = 7,87.10/56.90% = 1,5615 mol
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
→ nAl = 1,388 và nFe3O4 = 0,5205
→ mTecmit = 158,232 gam
Câu 38:
Cho dãy chuyển hóa sau:
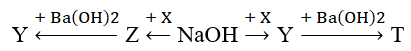
Chất X, Y tương ứng là
 Xem đáp án
Xem đáp án
Chất X, Y tương ứng là Ba(HCO3)2, Na2CO3.
2NaOH + Ba(HCO3)2 (X) → Na2CO3 (Y) + BaCO3 + 2H2O
Na2CO3 + Ba(OH)2 → BaCO3 (T) + 2NaOH
NaOH + Ba(HCO3)2 (X) → NaHCO3 (Z) + BaCO3 + H2O
2NaHCO3 + Ba(OH)2 → BaCO3 + Na2CO3 + 2H2O
Câu 39:
Hỗn hợp E gồm axit béo X và triglixerit Y. Đốt cháy hoàn toàn 52,86 gam hỗn hợp E bằng oxi, thu được 3,39 mol CO2 và 3,21 mol H2O. Mặt khác, thủy phân hoàn toàn 52,86 gam E trong dung dịch NaOH, thu được 4,6 gam glixerol và hỗn hợp F gồm hai muối natri oleat và natri stearat. Thành phần % theo khối lượng của X trong E là
 Xem đáp án
Xem đáp án
nO(E) = (mE – mC – mH)/16 = 0,36 → nNaOH = 0,18
nC3H5(OH)3 = 0,05
nNaOH = 3nC3H5(OH)3 + nH2O → nH2O = 0,03
Muối gồm C17H33COONa (u) và C17H35COONa (v)
nNaOH = u + v = 0,18
Bảo toàn khối lượng:
304u + 306v + 4,6 + 0,03.18 = 0,18.40 + 52,86
→ u = 0,08; v = 0,1
Kết hợp nX = 0,03; nY = 0,05 ta có:
Y là (C17H35COO)2 (C17H33COO)C3H5: 0,05 mol
X là C17H33COOH: 0,03 mol
→ %X = 16%
Câu 40:
Cho hai chất hữu cơ mạch hở E, F có cùng công thức đơn giản nhất là C2H3O. Các chất E, F tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
(1) E + NaOH (t°) → X1 + X2 (2) F + 2NaOH (t°) → X1 + X3 + X4
(3) X1 + HCl → X5 + NaCl (4) X3 + HCl → X6 + NaCl
(5) X6 (H2SO4, 170°C) → X5 + H2O
Biết rằng ME < MF < 200. Cho các phát biểu sau:
(a) Có hai công thức cấu tạo phù hợp với chất F.
(b) Từ các chất X2, X4 điều chế trực tiếp được axit axetic.
(c) Oxi hóa X4 bằng CuO, thu được anđehit axetic.
(d) Nung chất X1 với NaOH và CaO ở nhiệt độ cao, thu được khí metan.
(e) Cho a mol chất X6 tác dụng với Na dư, thu được a mol khí H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
ME < MF < 200 và E, F đều có số H chẵn nên E là C4H6O2 và F là C8H12O4
(3)(4) → X1, X3 đều chứa COONa
(5) → X6 có nhóm OH (để tách H2O tạo X5) → X5, X6 cùng C và ít nhất 3C
E là CH2=CH-COOCH3
X1 là CH2=CH-COONa; X2 là CH3OH
F là:
CH2=CH-COO-CH2-CH2-COO-C2H5
CH2=CH-COO-CH(CH3)-COO-C2H5
X3 là HOCH2CH2COONa hoặc HOCH(CH3)COONa
X4 là C2H5OH.
X5 là CH2=CH-COOH
X6 là HOCH2CH2COOH hoặc HOCH(CH3)COOH
(a) Đúng
(b) Đúng:
CH3OH + CO → CH3COOH
C2H5OH + O2 → CH3COOH + H2O
(c) Đúng: C2H5OH + CuO → CH3CHO + Cu + H2O
(d) Sai: CH2=CH-COONa + NaOH → CH2=CH2 + Na2CO3
(e) Đúng: HOCH2CH2COOH + 2Na → NaOCH2CH2COONa + H2
HOCH(CH3)COOH + 2Na → NaOCH(CH3)COONa + H2
