(2023) Đề thi thử Hóa THPT Đô Lương 1, Nghệ An (Lần 1) có đáp án
(2023) Đề thi thử Hóa THPT Đô Lương 1, Nghệ An (Lần 1) có đáp án
-
619 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Chất nào sau đây vừa tác dụng được với dung dịch KOH vừa tác dụng với dung dịch HNO3?
 Xem đáp án
Xem đáp án
Al2O3 vừa tác dụng được với dung dịch KOH vừa tác dụng với dung dịch HNO3:
Al2O3 + KOH —> KAlO2 + H2O
Al2O3 + HNO3 —> Al(NO3)3 + H2O
Chọn C
Câu 2:
Kim loại nào sau đây dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Độ dẫn điện: Ag > Cu > Au > Al > Fe —> Kim loại dẫn điện tốt nhất là Ag.
Chọn B
Câu 4:
Chất nào sau đây có khả năng làm mềm nước cứng vĩnh cửu?
 Xem đáp án
Xem đáp án
Na3PO4 có khả năng làm mềm nước cứng vĩnh cửu do loại bỏ được Ca2+, Mg2+ ra khỏi dung dịch:
Ca2+ + PO43- —> Ca3(PO4)2
Mg2+ + PO43- —> Mg3(PO4)2
Chọn B
Câu 6:
Amino axit nào sau đây có năm nguyên tử cacbon trong phân tử
 Xem đáp án
Xem đáp án
A. Valin: C5H11NO2
B. Glyxin: C2H5NO2
C. Lysin: C6H14N2O2
D. Alanin: C3H7NO2
Chọn A
Câu 8:
Cho 10,2 gam hỗn hợp X gồm Zn và Fe vào 325 ml dung dịch CuSO4 0,3M đến khi phản ứng hoàn toàn, thu được dung dịch Y và 10,44 gam hỗn hợp kim loại Z. Khối lượng Fe trong X là
 Xem đáp án
Xem đáp án
mZ > mX nên Fe đã phản ứng —> Zn hết
Z là hỗn hợp nên Fe còn dư —> Cu2+ hết
mFe dư = mZ – mCu = 4,2
Đặt a, b, c là số mol Zn, Fe phản ứng
mX = 65a + 56b + 4,2 = 10,2
nCuSO4 = a + b = 0,0975
—> a = 0,06; b = 0,0375
—> mFe trong X = 56b + 4,2 = 6,3
Chọn B
Câu 9:
Cho thứ tự bốn cặp oxi-hóa khử trong dãy điện hóa như sau: Na+/Na. Mg2+/Mg, Al3+/Al, Ag+/Ag. Cho biết trong bốn kim loại Na, Mg, Al, Ag thì kim loại có tính khử yếu nhất là
 Xem đáp án
Xem đáp án
Chọn A
Câu 12:
Người hút thuốc lá nhiều thường mắc các bệnh nguy hiểm về đường hô hấp. Chất gây hại chủ yếu có trong thuốc lá là
 Xem đáp án
Xem đáp án
Chọn C
Câu 15:
Cho các phát biểu sau:
(a) Tinh bột bị thủy phân trong môi trường kiềm.
(b) Triolein là chất lỏng tan nhiều trong nước.
(c) Các tripeptit đều tác dụng với Cu(OH)2 cho hợp chất có màu tím đặc trưng.
(d) Anilin (C6H5NH2) là rắn tan ít trong nước.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
(a) Sai, tinh bột bị thủy phân trong môi trường axit, không bị thủy phân trong môi trường kiềm.
(b) Sai, triolein là chất lỏng không tan trong nước.
(c) Đúng
(d) Sai, anilin là chất lỏng, ít trong nước.
Chọn B
Câu 19:
Kim loại Al không phản ứng với chất nào sau đây trong dung dịch?
 Xem đáp án
Xem đáp án
A. HCl + Al —> AlCl3 + H2
B. MgSO4 + Al: Không phản ứng
C. CuCl2 + Al —> AlCl3 + Cu
D. Fe2(SO4)3 + Al —> Al2(SO4)3 + FeSO4
Chọn B
Câu 20:
Tiến hành các thí nghiệm sau:
(a) Đốt dây Mg trong không khí.
(b) Sục khí Cl2 vào dung dịch FeSO4.
(c) Cho dung dịch H2SO4 loãng vào đung dịch Fe(NO3)2.
(d) Cho Br2 vào dung dịch hỗn hợp NaCrO2 và NaOH.
(e) Sục khí CO2 vào dung dịch Ca(OH)2.
(g) Đun sôi dung dịch Ca(HCO3)2.
Số thí nghiệm xảy ra phản ứng oxi hóa-khử là
 Xem đáp án
Xem đáp án
(a) Mg + O2 —> MgO; Mg + N2 —> Mg3N2
(b) Cl2 + FeSO4 —> FeCl3 + Fe2(SO4)3
(c) Fe2+ + H+ + NO3- —> Fe3+ + NO + H2O
(d) Br2 + NaCrO2 + NaOH —> Na2CrO4 + NaBr + H2O
(e) CO2 + Ca(OH)2 —> CaCO3 + H2O
(g) Ca(HCO3)2 —> CaCO3 + CO2 + H2O
Chọn D
Câu 21:
Tính oxi hóa của cacbon được thể hiện trong phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Tính oxi hóa của cacbon được thể hiện trong phản ứng C + 2Mg → Mg2C: Số oxi hóa của C giảm từ 0 xuống -4.
Chọn D
Câu 23:
Tiến hành thí nghiệm thử tính chất của glixerol và etanol với đồng(II) hiđroxit theo các bước sau đây:
Bước 1: Cho vào hai ống nghiệm, mỗi ống khoảng 3 – 4 giọt dung dịch CuSO4 2% và 2 – 3 giọt dung dịch NaOH 10%, lắc nhẹ.
Bước 2: Nhỏ 2 – 3 giọt glixerol vào ống nghiệm thứ nhất, 2 – 3 giọt etanol vào ống nghiệm thứ hai. Lắc nhẹ cả hai ống nghiệm.
Cho các phát biểu sau về thí nghiệm đã tiến hành ở trên:
(a) Sau bước 1, trong cả hai ống nghiệm đều có kết tủa màu xanh của đồng(II) hiđroxit.
(b) Sau bước 2, trong ống nghiệm thứ nhất kết tủa tan, tạo thành dung dịch màu xanh lam.
(c) Sau bước 2, trong cả hai ống nghiệm kết tủa tan, tạo thành dung dịch màu xanh lam.
(d) Sau bước 2, trong ống nghiệm thứ hai kết tủa màu xanh của đồng(II) hiđroxit không tan.
(e) Thí nghiệm trên, được dùng để phân biệt etanol và glixerol.
Số phat biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng, C3H5(OH)3 có các OH kề nhau nên hòa tan Cu(OH)2 tạo phức xanh lam
(c) Sai, etanol không hòa tan Cu(OH)2
(d) Đúng
(e) Đúng
Chọn D
Câu 24:
Trong tự nhiên, sắt tồn tại chủ yếu dưới dạng hợp chất. Một trong số quặng sắt có tên là hematit. Thành phần chính của quặng hematit là
 Xem đáp án
Xem đáp án
Chọn A
Câu 26:
Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy oxit của nó?
 Xem đáp án
Xem đáp án
Chọn B
Câu 27:
Este nào sau đây được điều chế bằng phản ứng este hóa?
 Xem đáp án
Xem đáp án
A. C2H5COOH + CH≡CH —> C2H5COOCH=CH2
B. CH3COOH + CH≡CH —> CH3COOCH=CH2
C. CH2=CHCOOH + CH3OH —> CH2=CHCOOCH3 + H2O
D. (CH3CO)2O + C6H5OH —> CH3COOC6H5 + CH3COOH
Chọn C
Câu 29:
Nung nóng a mol hỗn hợp X gồm propen, propin, H2 với xúc tác Ni trong bình kín (chỉ xảy ra phản ứng cộng H2), sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với X là 1,25. Đốt cháy hoàn toàn Y thu được 1,08 mol CO2 và 1,26 mol H2O. Mặt khác Y phản ứng với tối đa 0,42 mol Br2 trong dung dịch. Tổng số mol propin và H2 trong a mol X là
 Xem đáp án
Xem đáp án
nX/nY = MY/MX = 1,25
nX = a —> nY = 0,8a
nY = (nH2O + nBr2) – nCO2 —> a = 0,6
X gồm C3H6 (x), C3H4 (y), H2 (z)
nX = x + y + z = 0,6
nCO2 = 3x + 3y = 1,08
nH2O = 3x + 2y + z = 1,26
—> x = 0,3; y = 0,06; z = 0,24
—> nC3H4 + nH2 = 0,3
Chọn B
Câu 30:
Hỗn hợp E gồm X là este đơn chức và Y là este hai chức (X, Y đều no, mạch hở và số mol của X nhỏ hơn số mol của Y). Xà phòng hóa hoàn toàn m gam E bằng lượng vừa đủ dung dịch KOH, thu được hai ancol kế tiếp nhau trong dãy đồng đẳng và m gam muối. Mặt khác, khi đốt cháy hoàn toàn 23,32 gam E thì thu được 1,04 mol CO2. Khối lượng Y có trong 23,32 gam E là
 Xem đáp án
Xem đáp án
mE = m muối —> mAncol = mKOH
nAncol = nKOH —> M ancol = 56
—> Ancol gồm C2H5OH (2e) và C3H7OH (5e)
Do nX < nY nên X là ACOOC2H5 (2e) và Y là B(COOC3H7)2 (2,5e)
nB(COOC3H7)2 = nCO2 – nH2O —> nH2O = 1,04 – 2,5e
mE = mC + mH + mO
⇔ 23,32 = 1,04.12 + 2(1,04 – 2,5e) + 16.2.7e
—> e = 0,04
nCO2 = 0,08(CA + 3) + 0,1(CB + 8) = 1,04
—> 4CA + 5CB = 0 —> CA = CB = 0 là nghiệm duy nhất.
X là HCOOC2H5 (0,08) và Y là (COOC3H7)2 (0,1)
—> mY = 17,4 gam
Chọn C
Câu 31:
Hòa tan hết m gam hỗn hợp X gồm Na2O, K, K2O, Ba, BaO (trong đó O chiếm 10% khối lượng hỗn hợp) vào lượng H2O dư thu được dung dịch Y và 1,792 lít H2 (đktc). Dung dịch Y hòa tan tối đa 8,64 gam Al. Giá trị của m là
 Xem đáp án
Xem đáp án
nOH-(Y) = nAl = 0,32
Bảo toàn electron: 0,32 = 2nH2 + 2nO
—> nO = 0,08
—> mX = 0,08.16/10% = 12,8 gam
Chọn C
Câu 32:
Amino axit X có công thức (H2N)2C3H5COOH. Cho 0,02 mol X tác dụng với 200 ml dung dịch hỗn hợp H2SO4 0,1M và HCl 0,3M, thu được dung dịch Y. Cho Y phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M và KOH 0,2M, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Muối chứa:
(H2N)2C3H5COO-: 0,02
SO42-: 0,02
Cl-: 0,06
Na+: 0,04
K+: 0,08
—> m muối = 10,43
Chọn B
Câu 33:
Điện phân dung dịch chứa x mol CuSO4, y mol H2SO4 và z mol NaCl (với điện cực trơ, có mảng ngăn xốp, hiệu suất điện phân là 100%). Khối lượng dung dịch giảm và khối lượng Al2O3 bị hòa tan tối đa trong dung dịch sau điện phân ứng với mỗi thí nghiệm được cho ở bảng dưới đây:
|
|
Thí nghiệm 1 |
Thí nghiệm 2 |
Thí nghiệm 3 |
|
Thời gian điện phân (giây) |
t |
4t |
8t |
|
Khối lượng dung dịch giảm (gam) |
27 |
83,2 |
103,1 |
|
Khối lượng Al2O3 bị hòa tan tối đa (gam) |
13,6 |
0 |
10,2 |
Biết tại catot ion Cu2+ điện phân hết thành Cu trước khi ion H+ điện phân tạo thành khí H2, cường đi dòng điện bằng nhau và không đổi trong các thí nghiệm trên. Tổng giá trị (x + y + z) bằng
 Xem đáp án
Xem đáp án
Thời điểm 4t giây dung dịch không hòa tan được Al2O3 nên không chứa H+ hoặc OH- nhưng tới 8t giây thì dung dịch lại hòa tan được Al2O3 —> Lúc 4t giây phải có NaCl dư.
Lúc t giây: m giảm = 27 —> nCu = nCl2 = 0,2
nAl2O3 = 2/15 —> nH2SO4 = y = 3.2/15 = 0,4
Lúc 4t giây: ne = 4.0,2.2 = 1,6
Catot: nCu = x —> nH2 = 0,8 – x
Anot: nCl2 = 1,6/2 = 0,8
m giảm = 64x + 2(0,8 – x) + 0,8.71 = 83,2
—> x = 0,4
Lúc 8t giây: ne = 1,6.2 = 3,2
Catot: nCu = 0,4 —> nH2 = 1,2
Anot: nCl2 = 0,5z —> nO2 = 0,8 – 0,25z
m giảm = 0,4.64 + 1,2.2 + 71.0,5z + 32(0,8 – 0,25z) = 103,1
—> z = 1,8
—> x + y + z = 2,6
Chọn B
Câu 34:
Este E mạch hở có công thức phân tử C4H6O4. Từ E thực hiện sơ đồ các phản ứng sau (theo đúng tỉ lệ mol):
E + 2NaOH → X + 2Y
Y + HCl → Z + NaCl
Cho các phát biểu sau:
(a) Chất E có khả năng tham gia phản ứng tráng gương
(b) Chất X được điều chế trực tiếp từ etilen bằng một phản ứng.
(c) Đốt cháy hoàn toàn 1 mol Y cũng như Z ta đều thu được 1 mol CO2.
(d) Chất E được điều chế bằng phản ứng este hóa
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Y + HCl → Z + NaCl nên Y là muối có 1Na.
—> E là (HCOO)2C2H4
X là C2H4(OH)2; Y là HCOONa; Z là HCOOH.
(a) Đúng, E chứa HCOO- hay -O-CHO nên có tráng gương.
(b) Đúng: C2H4 + KMnO4 + H2O —> C2H4(OH)2 + KOH + MnO2
(c) Sai, đốt 1 mol Y chỉ thu được 0,5 mol CO2:
2HCOONa + O2 —> Na2CO3 + CO2 + H2O
(d) Đúng: HCOOH + C2H4(OH)2 ⇔ (HCOO)2C2H4 + H2O
Chọn D
Câu 35:
Khi phân tích một loại chất béo (kí hiệu là X) chứa đồng thời các triglixerit và axit béo tự do, (không có tạp chất khác) thấy oxi chiếm 10,88% theo khối lượng. Xà phòng hóa hoàn toàn m gam X bằng dung dịch NaOH dư đun nóng, sau phản ứng thu được dung dịch chứa 61,98 gam hỗn hợp các muối C17H35COONa, C17H33COONa, C17H31COONa và 6,072 gam glixerol. Giá trị của m gần nhất với
 Xem đáp án
Xem đáp án
nNaOH = a; nH2O = b; nC3H5(OH)3 = 0,066
—> a = b + 0,066.3
nO(X) = 2a, bảo toàn khối lượng:
16.2a/10,88% + 40a = 61,98 + 6,072 + 18b
—> a = 0,204; b = 0,006
m = 16.2a/10,88% = 60 gam
Chọn A
Câu 36:
Oxi hóa 0,16 mol một ancol đơn chức, thu được hỗn hợp X gồm một axit cacboxylic, một andehit, ancol dư và nước. Ngưng tụ toàn bộ X rồi chia làm hai phần bằng nhau. Phần một cho tác dụ hết với Na dư, thu được 1,008 lít khí H2 (đktc). Phần hai cho phản ứng tráng bạc hoàn toàn thu được 19,44 gam Ag. Phần trăm khối lượng ancol bị oxi hóa thành andehit là
 Xem đáp án
Xem đáp án
Trong mỗi phần của X đặt RCHO (a mol), RCOOH (b mol), H2O (a + b mol), RCH2OH dư (0,08 – a – b mol)
Phần 1:
nH2 = b/2 + (a + b)/2 + (0,08 – a – b)/2 = 0,045
—> b = 0,01
Phần 2:
TH1: nAg = 2a = 0,18 —> a = 0,09 > 0,08: Vô lý, loại.
TH2: nAg = 4a + 2b = 0,18 —> a = 0,04
(Lúc này andehit là HCHO và axit là HCOOH, chúng đều tráng gương)
—> %CH3OH bị oxi hóa thành andehit = a/0,08 = 50%
Chọn C
Câu 37:
Cho các phát biểu sau:
(a) Tinh bột bị thủy phân trong môi trường kiềm.
(b) Các a-amino axit là nguyên liệu để sản xuất tơ nilon.
(c) Glyxin tác dụng được với C2H5OH/HCl, đun nóng.
(d) Anilin (C6H5NH2) và phenol (C6H5OH) đều là chất lỏng ở điều kiện thường, không tan trong nước.
(e) Tơ olon dai, bền với nhiệt và giữ nhiệt tốt, dùng để bện sợi “len" đan áo rét.
(f) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, tinh bột bị thủy phân trong môi trường axit, không bị thủy phân trong môi trường kiềm.
(b) Sai
(c) Đúng, tạo NH3Cl-CH2-COOC2H5
(d) Sai, anilin là chất lỏng, phenol là chất rắn ở điều kiện thường.
(e) Đúng
(f) Đúng
Chọn D
Câu 38:
Hoà tan hoàn toàn 12,42 gam Al bằng dung dịch HNO3 loãng (dư), thu được dung dịch X và 1,344 lít (ở đktc) hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối của hỗn hợp khí Y so với khí H2 là 18. Cô cạn dung dịch X, thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Khí X chứa nN2O = nN2 = 0,03
Bảo toàn electron:
3nAl = 8nN2O + 10nN2 + 8nNH4NO3
—> nNH4NO3 = 0,105
—> m muối = mAl(NO3)3 + mNH4NO3 = 106,38
Chọn C
Câu 39:
Tinh thể CuSO4.5H2O thường dùng làm chất diệt nấm, sát khuẩn… Khi nung nóng khối lượng CuSO4.5H2O giảm dần. Đồ thị sau đây biểu diễn độ giảm khối lượng của CuSO4.5H2O khi tăng dần nhiệt độ:
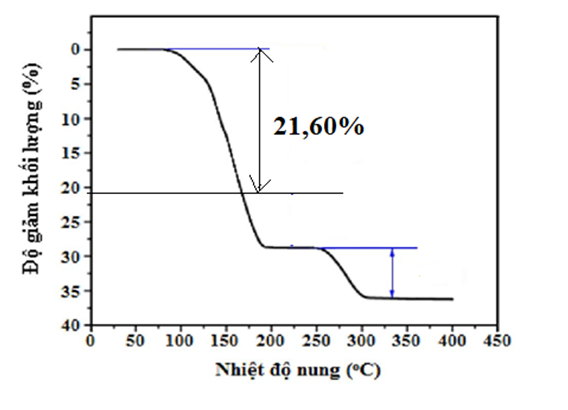
Thành phần chất rắn sau khi nhiệt độ đạt đến 200°C là
 Xem đáp án
Xem đáp án
Khi nung tới 200°C:
CuSO4.5H2O —> CuSO4.(5-x)H2O + xH2O
m giảm = 18x = 21,6%.250 —> x = 3
—> Chất rắn là CuSO4.2H2O
Chọn B
Câu 40:
Có các phát biểu sau:
(1) Trong công nghiệp dược phẩm, saccarozơ được dùng làm thuốc.
(2) Xenlulozơ là nguyên liệu để sản xuất tơ nhân tạo và chế tạo thuốc súng không khói.
(3) Oxi hóa glucozơ bằng H2 thu được sobitol.
(4) Tinh bột và xenlulozơ đều có công thức dạng (C6H10O5)n nên đều có mạch không phân nhánh.
Số phát biểu không đúng là
 Xem đáp án
Xem đáp án
(1)(2) Đúng
(3) Sai, khử glucozơ bằng H2 thu được sobitol.
(4) Sai, amilozơ và xenlulozơ không phân nhánh, amilopectin có phân nhánh.
Chọn B
