(2023) Đề thi thử Hóa Sở giáo dục đào tạo Sơn La (Lần 1) có đáp án
(2023) Đề thi thử Hóa Sở giáo dục đào tạo Sơn La (Lần 1) có đáp án
-
1032 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 3:
Chất nào sau đây tác dụng với dung dịch Ba(OH)2 không tạo ra kết tủa?
 Xem đáp án
Xem đáp án
A. HCl + Ba(HCO3)2 → BaCl2 + CO2 + H2O
B. Ca(HCO3)2 + Ba(HCO3)2 → BaCO3 + CaCO3 + H2O
C. Na2SO4 + Ba(HCO3)2 → BaSO4 + NaHCO3
D. NaHCO3 + Ba(HCO3)2: Không phản ứng
Câu 6:
Kali cromat là chất rắn ở dạng tinh thể màu vàng và khá phổ biến trong phòng thí nghiệm. Công thức của kali cromat là
 Xem đáp án
Xem đáp án
Chọn D
Câu 10:
Thủy tinh hữu cơ plexiglas là loại polime rất bền, trong suốt, có thể cho gần 90% ánh sáng truyền qua nên được sử dụng làm kính ô tô, máy bay, kính xây dựng, kính bảo hiểm,… Polime
dùng để chế tạo thủy tinh hữu cơ có tên gọi là
 Xem đáp án
Xem đáp án
Chọn B
Câu 14:
Sắt phản ứng với lượng dư chất nào sau đây sinh ra muối sắt(II)?
 Xem đáp án
Xem đáp án
A. Fe + H2SO4 loãng → FeSO4 + H2
B. Fe + O2 dư → Fe2O3 (oxit bazơ)
C. Fe + HNO3 đặc nóng, dư → Fe(NO3)3 + NO2 + H2O
D. Không phản ứng.
Câu 15:
Chất nào sau đây được dùng để làm mềm nước cứng có tính cứng vĩnh cửu?
 Xem đáp án
Xem đáp án
Na3PO4 có khả năng làm mềm nước cứng vĩnh cửu do loại bỏ được Ca2+, Mg2+ ra khỏi dung dịch:
Ca2+ + PO43- → Ca3(PO4)2
Mg2+ + PO43- → Mg3(PO4)2
Câu 18:
Chất nào sau đây tác dụng với nước sinh ra khí H2?
 Xem đáp án
Xem đáp án
A. Không phản ứng
B. Na + H2O → NaOH + H2
C. K2O + H2O → KOH
D. BaO + H2O → Ba(OH)2
Câu 20:
Chất nào sau đây tác dụng với dung dịch NaHCO3 không sinh ra khí CO2?
 Xem đáp án
Xem đáp án
A. NaHSO4 + NaHCO3 → Na2SO4 + CO2 + H2O
B. HNO3 + NaHCO3 → NaNO3 + CO2 + H2O
C. H2SO4 + NaHCO3 → Na2SO4 + CO2 + H2O
D. NaOH + NaHCO3 → Na2CO2 + H2OCâu 21:
Đốt cháy hoàn toàn một lượng este X (no, đơn chức, mạch hở) cần vừa đủ a mol O2, thu được a mol H2O. Mặt khác, cho 0,1 mol X tác dụng vừa đủ với dung dịch KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nCO2 = nH2O = a, bảo toàn O → nX = 0,5a
Số C = nCO2/nX = 2
→ X là HCOOCH3 (0,1 mol)
→ mHCOOK = 8,4 gam
Câu 22:
Đốt cháy hoàn toàn 1,24 gam amin X (no, đơn chức, mạch hở) trong oxi dư thu được 0,04 mol CO2. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
X là CxH2x+3N (0,04/x mol)
MX = 14x + 17 = 1,24x/0,04
→ x = 1 → X là CH5N
Câu 23:
Tinh thể chất rắn X không màu, vị ngọt, dễ tan trong nước. X có nhiều trong cây mía, củ cải đường và hoa thốt nốt. Trong công nghiệp, X được chuyển hóa thành chất Y dùng để tráng gương, tráng ruột phích. Tên gọi của X và Y lần lượt là
 Xem đáp án
Xem đáp án
X có nhiều trong cây mía, củ cải đường và hoa thốt nốt → X là saccarozơ.
Từ X được chuyển hóa thành chất Y dùng để tráng gương, tráng ruột phích → Y là glucozơ.
Câu 24:
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị không đổi) cần vừa đủ 5,6 lít hỗn hợp khí Cl2 và O2 (có tỉ lệ mol 4 : 1). Kim loại M là
 Xem đáp án
Xem đáp án
n khí = 0,25 → nCl2 = 0,2; nO2 = 0,05
Kim loại M hóa trị x, bảo toàn electron:
x.nM = 2nCl2 + 4nO2
⇔ 7,2x/M = 0,2.2 + 0,05.4
→ M = 12x
→ x = 2, M = 24: M là Mg
Câu 25:
Hòa tan hết m gam hỗn hợp gồm Cu(OH)2 và Fe(OH)3 cần vừa đủ 40 ml dung dịch H2SO4 1M, sau phản ứng thu được dung dịch chứa 5,60 gam hỗn hợp muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nH2SO4 = 0,04 → nH2O = nH+ = 0,08
Bảo toàn khối lượng:
m + mH2SO4 = m muối + mH2O → m = 3,12 gam
Câu 26:
Xà phòng hóa este X có công thức phân tử C4H8O2 bằng dung dịch KOH dư thu được muối Y và ancol Z (Y và Z có cùng số nguyên tử cacbon). Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
Y và Z có cùng số nguyên tử cacbon → Mỗi chất 2C
→ X là CH3COOC2H5
Câu 27:
Thí nghiệm nào sau đây không có kết tủa hoặc khí sinh ra?
 Xem đáp án
Xem đáp án
A. Không phản ứng
B. Fe + HNO3 loãng → Fe(NO3)3 + NO + H2O
C. NaOH + Ba(HCO3)2 → BaCO3 + Na2CO3 + H2O
D. CO2 dư + H2O + NaAlO2 → Al(OH)3 + NaHCO3
Câu 28:
Hòa tan Fe3O4 bằng lượng vừa đủ dung dịch HCl, thu được dung dịch X. Cho dung dịch X lần lượt tác dụng với các chất: NaOH, Fe, AgNO3, Cl2. Số chất phản ứng với dung dịch X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 30:
Cho 200 ml dung dịch glucozơ 1M tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng nhẹ, thu được m gam Ag. Biết phản ứng xảy ra hoàn toàn. Giá trị m là
 Xem đáp án
Xem đáp án
Chọn B
Câu 31:
Thực hiện các thí nghiệm sau:
(a) Dẫn khí NH3 vào dung dịch FeCl3.
(b) Cho CuS vào dung dịch HCl.
(c) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(d) Dẫn khí CO2 vào dung dịch Na2CO3.
(đ) Cho dung dịch NaOH vào nước cứng tạm thời.
Số thí nghiệm xảy ra phản ứng ở điều kiện thường là
 Xem đáp án
Xem đáp án
(a) NH3 + H2O + FeCl3 → Fe(OH)3 + NH4Cl
(b) Không phản ứng
(c) Fe(NO3)2 + HCl → Fe(NO3)3 + FeCl3 + NO + H2O
(d) CO2 + H2O + Na2CO3 → NaHCO3
(đ) NaOH + M(HCO3)2 → Na2CO3 + MCO3 + H2O
Câu 32:
Hỗn hợp E gồm Fe, Fe3O4, FeCO3 và Fe(NO3)2. Nung 19,28 gam E trong môi trường trơ thu được chất rắn X (chỉ gồm Fe và các oxit) và 2,24 lít hỗn hợp khí CO2 và NO2 có tỉ khối so với hiđro bằng 22,8. Hòa tan hết X trong dung dịch HCl nồng độ 3,65% thu được 1,232 lít khí H2 và dung dịch Y chỉ chứa muối. Cho tiếp dung dịch AgNO3 dư vào Y thu được 84,325 gam kết tủa gồm Ag và AgCl. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của muối FeCl3 trong Y gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Y gồm FeCl2 (a), FeCl3 (b)
→ m↓ = 143,5(2a + 3b) + 108a = 84,325 (1)
nH2O = nO(X) = c; m khí = 0,1.2.22,8 = 4,56
→ mE = 56(a + b) + 16c + 4,56 = 19,28 (2)
nH2 = 0,055
Bảo toàn electron: 3(a + b) = 2c + a + 0,055.2 (3)
(1)(2)(3) → a = 0,05; b = 0,15; c = 0,22
nHCl = 2nH2 + 2nH2O = 0,55
mddY = mX + mddHCl – mH2 = 564,61
→ C%FeCl3 = 4,32%
Câu 33:
Cho các phát biểu sau:
(a) Dung dịch formol dùng để bảo quản thực phẩm (thịt, cá…).
(b) Đồng trùng hợp buta-1,3-đien với lưu huỳnh thu được cao su buna-S.
(c) Dầu, mỡ sau khi rán, có thể được dùng để tái chế thành nhiên liệu.
(d) Trong công nghiệp, tinh bột được dùng để sản xuất bánh kẹo, glucozơ, hồ dán.
(đ) 1 mol đipeptit Glu-Lys tác dụng tối đa với dung dịch chứa 3 mol HCl.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, formol độc nên dùng để bảo quản xác, không dùng trong thực phẩm.
(b) Sai, đồng trùng hợp buta-1,3-đien với stiren thu được cao su buna-S.
(c) Đúng
(d) Đúng
(đ) Đúng: Glu-Lys + H2O + 3HCl → GluHCl + Lys(HCl)2.
Câu 34:
Cho sơ đồ các phản ứng sau:
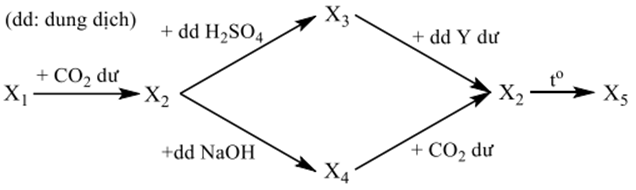
Biết X1, X2, X3, X4, X5 là các chất khác nhau của nguyên tố nhôm. Các chất X1 và Y lần lượt là
 Xem đáp án
Xem đáp án
X1 là muối AlO2- → Loại B.
X2 là Al(OH)3; X3 là Al2(SO4)3; X4 là NaAlO2
X5 là Al2O3
X1 khác X4 nên loại A, D → Chọn C.
Câu 35:
Hòa tan hoàn toàn m gam hỗn hợp CuSO4 và KCl vào nước, được dung dịch X. Điện phân dung dịch X với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 1737 |
2t |
|
Tổng số mol khí ở 2 điện cực |
a |
a + 0,0145 |
2a + 0,01 |
|
Số mol Cu ở catot |
b |
b + 0,015 |
b + 0,015 |
Giá trị của m là
 Xem đáp án
Xem đáp án
Trong khoảng thời gian 1737s (từ t đến t + 1737) có ne = 1737.2/96500 = 0,036 mol.
+ Catot: nCu = 0,015 → nH2 = 0,003
+ Anot: nCl2 = u và nO2 = v
→ u + v + 0,003 = 0,0145 và 2u + 4v = 0,036
→ u = 0,005; v = 0,0065
Thời điểm t giây chưa thoát H2 và O2 nên a = b
Thời điểm 2t giây: ne = 4a = 4b
+ Catot: nCu = a + 0,015 → nH2 = a – 0,015
+ Anot: nCl2 = a + 0,005 → nO2 = 0,5a – 0,0025
nCl2 + nH2 + nO2 = (a + 0,005) + (a – 0,015) + (0,5a – 0,0025) = 2a + 0,01
→ a = 0,045
nCuSO4 = a + 0,015 = 0,06
nKCl = 2(a + 0,005) = 0,1
→ m = 17,05
Câu 36:
Hỗn hợp E gồm axit cacboxylic X, este Y (no, đơn chức) và este Z (ba chức) đều mạch hở. Thủy phân hoàn toàn m gam E trong dung dịch chứa 0,195 mol NaOH đun nóng (vừa đủ), thu được 6,24 gam hỗn hợp F gồm hai ancol có cùng số nguyên tử cacbon (hơn kém nhau 0,03 mol) và 13,56 gam hỗn hợp T gồm ba muối (trong đó có chứa hai muối của hai axit cacboxylic kế tiếp nhau trong dãy đồng đẳng). Mặt khác, đốt cháy hoàn toàn m gam E cần dùng 0,45 mol O2, thu được CO2 và 0,36 mol H2O. Thành phần trăm theo khối lượng của Y trong E là
 Xem đáp án
Xem đáp án
nNaOH = 0,195 → nO(E) = 0,39
Bảo toàn O → nCO2 = 0,465
Bảo toàn khối lượng:
+ Cho phản ứng cháy → mE = 12,54
+ Cho phản ứng với NaOH → nH2O = 0,03
→ nOH(ancol) = 0,195 – 0,03 = 0,165
Ancol dạng R(OH)r (0,165/r)
→ M ancol = R + 17r = 6,24r/0,165
→ R = 20,8r
1 < r < 3 → 20,8 < R < 62,4, mặt khác 2 ancol cùng C → C2, C3 hoặc C4
Trong 2 ancol có 1 ancol đơn chức và số mol hơn kém 0,03 → Chọn C2H5OH (0,075) và C2H4(OH)2 (0,045)
Quy đổi T thành COONa (0,195), C (0,03) và H (0,135)
(Bảo toàn C tính nC, từ mT tính nH)
→ CH3COONa (0,03), HCOONa (0,045) và (COONa)2 (0,06)
Z là HCOO-CH2-CH2-OOC-COO-C2H5: 0,045 mol
X là (COOH)2: 0,06 – 0,045 = 0,015
Y là CH3COOC2H5: 0,03
(Xây dựng Z trước, phần thừa còn lại dồn cho X, Y)
→ %Y = 21,05%
Câu 37:
Một trang trại cần 100 kg phân bón NPK có độ dinh dưỡng là 10-6-10 để bón ngay (tránh sự biến đổi hóa học của phân theo thời gian), từ sự phối trộn 4 nguyên liệu: amoni sunfat (loại có độ dinh dưỡng là 21%), supephotphat (độ dinh dưỡng là 20%), kali clorua (độ dinh dưỡng là 60%) và mùn hữu cơ (chất phụ gia). Khối lượng chất phụ gia cần dùng là
 Xem đáp án
Xem đáp án
Khối lượng 3 loại phân cần dùng là amoni sunfat (x kg), supephotphat (y kg), kali clorua (z kg)
mN = 10 = 21%x → x = 47,62
mP2O5 = 6 = 20%y → y = 30
mK2O = 10 = 60%z → z = 16,67
→ m phụ gia = 100 – (x + y + z) = 5,71
Câu 38:
Cho E (C4H6O4) và F (C5H8O5) là các chất hữu cơ mạch hở. Từ E, F thực hiện sơ đồ các phản ứng sau (theo đúng tỉ lệ mol):
(1) E + 2NaOH → X + 2Y
(2) F + 2NaOH → X + Y + Z
(3) Y + HCl → T + NaCl
Biết X, Y, Z, T là các hợp chất hữu cơ. Cho các phát biểu sau:
(a) Chất X có số nguyên tử oxi bằng số nguyên tử cacbon.
(b) Phân tử chất Z chứa đồng thời nhóm -OH và nhóm -COONa.
(c) Chất X có thể được điều chế trực tiếp từ etilen.
(d) Nhiệt độ sôi của chất T nhỏ hơn nhiệt độ sôi của ancol etylic.
(đ) 1 mol chất T tác dụng với Na dư thu được tối đa 1 mol khí H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(3) → Y chứa Na
(1) → E là (HCOO)2C2H4; X là C2H4(OH)2; Y là HCOONa
→ T là HCOOH
(2) → F là HCOO-CH2-CH2-OOC-CH2-OH
Z là HO-CH2-COONa
(a) Đúng, X là C2H6O2
(b) Đúng
(c) Đúng: C2H4 + KMnO4 + H2O → C2H4(OH)2 + KOH + MnO2
(d) Sai, T có liên kết H liên phân tử bền hơn C2H5OH nên nhiệt độ sôi của T cao hơn.
(đ) Sai, HCOOH + Na → HCOONa + 0,5H2
Câu 39:
Butan là một trong hai thành phần chính của khí đốt hóa lỏng (Liquified Petroleum Gas viết tắt là LPG). Khi đốt cháy 1 mol butan tỏa ra lượng nhiệt là 2850 kJ. Để thực hiện việc đun nóng 1 gam nước tăng thêm 1°C cần cung cấp nhiệt lượng là 4,18J. Biết rằng khối lượng riêng của nước là 1 g/ml và hiệu suất sử dụng nhiệt là 60%. Khối lượng butan cần đốt để đưa 2,5 lít nước từ 25°C lên 100°C là
 Xem đáp án
Xem đáp án
nC4H10 = x, bảo toàn năng lượng:
2850.10³x.60% = 2.5.10³.1.4,18.(100 – 25)
→ x = 0,4583
→ mC4H10 = 58x = 26,58 gam
Câu 40:
Triglixerit X được tạo bởi glixerol và ba axit béo gồm: axit panmitic, axit oleic và axit Y. Cho m gam E gồm X và Y tác dụng vừa đủ với dung dịch KOH, thu được glixerol và 15,68 gam muối. Đốt cháy hoàn toàn m gam E thu được 0,91 mol CO2 và 0,82 mol H2O. Mặt khác, m gam hỗn hợp E tác dụng tối đa với 0,07 mol Br2 trong dung dịch. Phần trăm khối lượng của Y trong E là
 Xem đáp án
Xem đáp án
nX = [nCO2 – (nH2O + nBr2)]/2 = 0,01; nY = y
Bảo toàn khối lượng:
0,91.12 + 0,82.2 + 16(2y + 0,01.6) + 56(y + 0,01.3) = 15,68 + 0,01.92 + 18y
→ y = 0,02
→ mE = 0,91.12 + 0,82.2 + 16(2y + 0,01.6) = 14,16
E gồm (C15H31COO)(C17H33COO)(RCOO)C3H5 (0,01) và RCOOH (0,02)
mE = 0,01(R + 621) + 0,02(R + 45) = 14,16
→ R = 235
→ %Y = 0,02(R + 45)/14,16 = 39,55%
