Các hình vẽ sau mô tả các cách thu khí thường được sử dụng khi điều chế và thu khí trong phòng thí nghiệm. Cách thu khí ở hình nào phù hợp với ammonia?
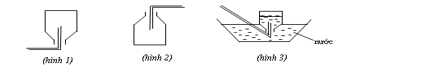
A. Hình 1.
B. Hình 2.
 Giải bởi Vietjack
Giải bởi Vietjack
Chọn A
Dịch vị dạ dày của con người có chứa hydrochloric acid (HCl), với pH dao động trong khoảng 1,5 – 3,5. Những người bị mắc bệnh viêm loét dạ dày, tá tràng thường có pH thấp hơn. Nabica (có thành phần chính là NaHCO3) là một loại thuốc được dùng để trung hoà bớt lượng acid trong dạ dày của những bệnh nhân có pH trong dạ dày thấp. (Phản ứng hóa học xảy ra: NaHCO3 + HCl → NaCl + CO2 + H2O).
Giả sử một bệnh nhân bị đau dạ dày đã uống 0,42 gam bột NaHCO3, hãy tính số mol HCl đã được trung hòa?
Nung m gam hỗn hợp X gồm Cu, Zn, Mg trong O2 dư đến khi phản ứng hoàn toàn, thu được 48,3 gam hỗn hợp 3 oxide kim loại. Nếu cho 0,5m gam X tác dụng hết với dung dịch HNO3 thì thu được 3,7185 lít hỗn hợp khí Y gồm NO và khí N2O, không còn sản phẩm khử nào khác. Tỉ khối của Y so với H2 là 52/3. Giá trị của m là
Acetic acid là một acid yếu, trong dung dịch điện li theo phương trình:
CH3COOH ⇌ CH3COO- + H+
Thực nghiệm cho biết 1 lít dung dịch CH3COOH 0,1M có [H+] = 5.10-4 M.
Cho thêm 0,01 mol CH3COONa vào 1 lít dung dịch trên thì pH của dung dịch lúc này bằng bao nhiêu?
Xét cân bằng ở nhiệt độ không đổi:
(1) H2(g) + I2(g) ⇌ 2HI(g) (K1)
(2) 2HI(g) ⇌ H2(g) + I2(g) (K2)
(Trong đó K1, K2 lần lượt là hằng số cân bằng của phản ứng 1 và phản ứng 2). Mối quan hệ giữa K1 và K2 là
Cho phương trình nhiệt hóa học:
3H2(g) + N2(g) 2NH3(g) = –91,80 kJ
Lượng nhiệt tỏa ra tối đa khi dùng 9 gam H2(g) để tạo thành NH3(g) là
Cho một ít chỉ thị phenolphtalein vào dung dịch NH3 loãng thu được dung dịch A có màu hồng. Tiến hành các thí nghiệm riêng biệt sau với dung dịch A:
(a) Đun nóng dung dịch A một hồi lâu thấy màu hồng nhạt dần.
(b) Thêm một lượng HCl có số mol bằng số mol của NH3 có trong dung dịch A thấy dung dịch thành không màu.
(c) Thêm một ít Na2CO3 thấy màu sắc dung dịch A không thay đổi.
(d) Thêm AlCl3 tới dư thấy màu hồng mất dần.
Những thí nghiệm mô tả đúng hiện tượng quan sát được là
Cho hai phương trình hoá học sau:
N2(g) + O2(g) → 2NO(g) ∆rH°298 = 180 kJ (1)
2NO(g) + O2(g) → 2NO2(g) ∆rH°298 = -114 kJ (2)
Trong số các phát biểu sau về hai phương trình hoá học trên, có bao nhiêu phát biểu đúng?
(a) Phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng toả nhiệt.
(b) Phản ứng (2) tạo NO2 từ NO, là quá trình thuận lợi về mặt năng lượng. Điều này cũng phù hợp với thực tế là khí NO (không màu) nhanh chóng bị oxi hoá thành khí NO2 (màu nâu đỏ).
(c) Enthalpy tạo thành chuẩn của NO2 là 80 kJ mol-1.
(d) Từ giá trị biến thiên enthalpy chuẩn của phản ứng (1) và năng lượng liên kết trong phân tử O2, N2 lần lượt là 498 kJ mol-1 và 946 kJ mol-1, tính được năng lượng liên kết trong phân tử NO ở cùng điều kiện là 632 kJ mol-1.
Cho các phát biểu sau:
(a) Các phản ứng xảy ra ở 3 giai đoạn trên đều có sự thay đổi số oxi hóa của nitrogen.
(b) Ở giai đoạn đầu tiên, thực tế người ta thay NH3 bằng N2 để thực hiện phản ứng oxi hóa N2 thành NO.
(c) Xúc tác dùng cho phản ứng ở giai đoạn đầu tiên là O2.
(d) Để điều chế 200 tấn nitric acid có nồng độ 60% cần dùng 33,66 tấn ammonia. Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơ đồ trên là 96,2%.
Số phát biểu không đúng là
Ngoài ứng dụng làm phân bón, ammonium chloride còn được sử dụng trong pin với vai trò chất điện li, hay dùng để làm sạch các oxide trên bề mặt các kim loại trước khi hàn. Công thức hóa học của ammonium chloride là
Mối quan hệ giữa tốc độ phản ứng thuận vt và tốc độ phản ứng nghịch vn ở trạng thái cân bằng được biểu diễn như thế nào?
Calcium hydroxide rắn được hòa tan trong nước cho tới khi pH của dung dịch đạt 10,8. Nồng độ của ion OH- trong dung dịch là
Nitric acid đặc tạo được với hydrochloric acid đặc hỗn hợp có tính oxi hóa mạnh (thường được gọi là nước cường toan) có khả năng hòa tan gold theo phản ứng:
Au + HNO3 + HCl AuCl3 + NO + H2O
Hãy tính tổng hệ số của các chất trong PTHH (các hệ số được lấy đến các số nguyên, tối giản).
Cho các phát biểu sau :
(a) Khi có sấm chớp khí quyển sinh ra chất NO.
(b) Ở nhiệt độ thường, nitrogen khá trơ về mặt hóa học là do phân tử nitrogen có liên kết ba bền.
(c) Trong công nghiệp, người ta thường sản xuất NH3 từ NH4Cl.
(d) Tính base của NH3 do phân tử có 3 liên kết cộng hóa trị phân cực.
(e) Để tạo độ xốp cho một số loại bánh, có thể dùng muối NH4HCO3 làm bột nở.
(f) Có thể dùng P2O5 để làm khô khí ammonia.
Số phát biểu đúng là