Dung dịch BaCl2 2M có nồng độ mol/l của anion là
A. 4M
B. 1M
C. 2M
D. 0,5M
 Giải bởi Vietjack
Giải bởi Vietjack
Theo định luật bảo toàn nguyên tố:
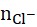 =
=![]()
Mặt khác BaCl2 là chất điện li mạnh, phân li hoàn toàn thành các ion => [Cl-] = 2.CM dd BaCl2 = 4M
Đáp án cần chọn là: A
Trong các yếu tố sau
(1) Nhiệt độ
(2) Áp suất
(3) Xúc tác
(4) Nồng độ chất tan
(5) Diện tích tiếp xúc
(6) Bản chất chất điện li
Yếu tố nào ảnh hưởng đến hằng số điện li ?
A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là
Độ điện li của dung dịch axit HCOOH 0,005M (biết trong dung dịch có [H+] = 0,001M) là
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
Hòa tan các chất sau vào nước để được các dung dịch riêng rẽ: NaCl, CaO, SO3, C6H12O6, CH3COOH, C2H5OH, Al2(SO4)3. Trong các dung dịch tạo ra có bao nhiêu dung dịch có khả năng dẫn điện?
Cho các mệnh đề sau
1 Chất điện ly mạnh có độ điện ly (α ) > 1.
2 Chất điện ly mạnh có độ điện ly (α ) = 1.
3 Chất không điện ly có độ điện ly (α ) = 0.
4 Chất điện ly yếu có độ điện ly (α ) = 1.
5 Chất điện ly yếu có độ điện ly 0 < (α ) < 1.
Chọn đáp án đúng
Cho các chất sau: SO2, C6H6 , C2H6, Ca(HCO3)2, H2SO4, NaClO, Mg(OH)2. Số chất hòa tan vào trong nước tạo thành chất điện li là:
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Tính nồng độ mol của CH3COOH, CH3COO− và H+ trong dung dịch CH3COOH 0,056M, biết rằng độ điện li α của CH3COOH bằng 20%.
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
Dung dịch HF 0,02M có độ điện li α = 0,015. Nồng độ ion H+ có trong dung dịch là