Điện phân hỗn hợp 0,2 mol NaCl và a mol Cu(NO3)2 sau một thời gian thu được dung dịch X và khối lượng dung dịch X giảm 21,5. Cho thanh sắt vào dung dịch X đến phản ứng hoàn toàn thấy khối lượng thanh sắt giảm 2,6 gam và thoát ra khí NO duy nhất. Tính a?
D. 0,2.
 Giải bởi Vietjack
Giải bởi Vietjack
n Cl- = 0,2 mol => n Cl2 = 0,1 mol
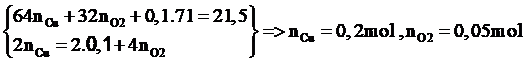
2 H2O → 4 H+ + O2 + 4 e
n O2 = 0,05 mol => n H+ = 0,2 mol = n HNO3
Fe + 4 HNO3→ Fe(NO3)3 + 2 H2O + NO
0,05 <= 0,2 => 0,05
Fe + 2 Fe(NO3)3 → 3 Fe(NO3)2
0,025 <=0,05
=> m Fe = 56 . ( 0,025 + 0,05 ) = 4,2 gam > 2,6 gam
=> có phản ứng của Fe với muối Cu2+
Fe + Cu(NO3)2→ Fe(NO3)2 + Cu
=> m tăng của phản ứng = 4,2 – 2,6 = 1,6 g
=> n Cu(NO3)2 = 1,6 : (64 – 56 ) = 0,2 mol
Vậy tổng số mol = 0,2 + 0,2 = 0,4 molChọn đáp án C.
Cho m gam hỗn hợp X gồm Mg, Na, K và Ba vào dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y và 5,04 lít H2 (đktc). Cô cạn toàn bộ dung dịch Y thu được 29,475 gam hỗn hợp muối khan. Giá trị của m là
Để làm sạch loại thủy ngân có lẫn tạp chất là Zn,Sn,Pb cần khuấy loại thủy ngân này trong:
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm:
Hỗn hợp X gồm Fe và Cu có khối lượng là 42 gam. Chia X thành hai phần không bằng nhau.
Phần 1: cho tác dụng với dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc).
Phần 2: Cho tác dụng với dung dịch HNO3 đặc, nóng dư, thì có 2,5 mol HNO3 đã phản ứng, sau phản ứng hoàn toàn, thu được dung dịch chứa m gam hỗn hợp muối.
Giá trị của m là
Ion kim loại nào sau đây làm ngọn lửa đèn khí nhuốm màu vàng tươi ?