Nguyên tử nguyên tố X có 1 electron lớp ngoài cùng và có tổng số electron ở phân lớp d và p là 17. Số hiệu của X là
A. 24.
B. 25.
C. 29.
D. 19.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án A
Phân tử có 1 electron lớp ngoài cùng tức là nó có dạng ns1
Ta thấy: theo dãy 1s22s22p63s23p64s23d10...
Tổng số e ở phân lớp p và d là 22.
Như vậy, nguyên tử có dạng 4s1.
Từ dãy trên, ta tính được số e ở phân lớp p là 12 và số e ở phân lớp d là 5.
Vậy, nguyên tử có cấu hình 1s22s22p63s23p63d54s1
Tổng số e là 24
=> Đáp án A
Nguyên tử của nguyên tố X có tổng số electron ở các phân lớp p là 11. Nguyên tố X thuộc loại nguyên tố
Nguyên tử của nguyên tố A có phân lớp ngoài cùng là 3p. Tổng electron ở các phân lớp p là 9. Nguyên tố A là:
Nguyên tử của nguyên tố A và B đều có phân lớp ngoài cùng là 2p. Tổng số e ở hai phân lớp ngoài cùng hai nguyên tử này là 3. Vậy số hiệu nguyên tử của A và B lần lượt là:
Nguyên tử nguyên tố X có e cuối cùng điền vào phân lớp 3p1.Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3.Số proton của X,Y lần lượt là :
Cấu hình electron của nguyên tố X là 1s22s22p63s1. Biết rằng X có số khối là 24 thì trong hạt nhân của X có:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp s là 7. X không phải nguyên tố nào dưới đây ?
Nguyên tử R mất đi 1 electron tạo ra cation R+ có cấu hình electron ở phân lớp ngoài cùng là 2p6. Cấu hình electron và số hiệu nguyên tử của R lần lượt là
Nguyên tử X có tổng số hạt p,n,e là 52 và số khối là 35. Cấu hình electron của X là
Cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X được phân bố như sau :
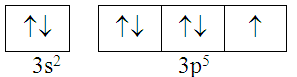
Số hiệu nguyên tử và kí hiệu của nguyên tố X là
Nguyên tử X có 19 electron. Ở trạng thái cơ bản X có số obitan chứa e là :
Nguyên tử của nguyên tố X có tổng số electron ở phân lớp d là 6. Nguyên tố X thuộc loại nguyên tố