Nguyên tử nguyên tố sodium có 11 electron. Nguyên tử này có
A. 1 lớp electron.
B. 2 lớp electron.
C. 3 lớp electron.
D. 4 lớp electron.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: C
Các electron được phân bố vào lớp gần hạt nhân trước. Số electron tối đa trong mỗi lớp là 2n2 (n là số thứ tự lớp electron, n ≤ 4).
Nguyên tử nguyên tố sodium có 11 electron được phân bố như sau;
+ Lớp thứ nhất (lớp K) có chứa tối đa 2 electron.
+ Lớp thứ hai (lớp L) có chứ tối đa 8 electron.
+ Còn lại 1 electron phân bố vào lớp thứ ba (lớp M).
Nguyên tử nguyên tố sodium có 3 lớp electron.
Cho mô hình nguyên tử của nguyên tố nitrogen (N) như sau:
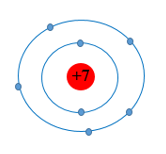
Số proton và số electron lớp ngoài cùng của nguyên tử N lần lượt là
Nguyên tử nguyên tố X có 8 neutron và có số khối là 16. Lớp ngoài cùng của nguyên tử X có
Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là
Mô hình nguyên tử theo Rutherford – Bohr không có nội dung nào sau đây?
Nguyên tử nguyên tố magnesium có 3 lớp electron, trong đó lớp ngoài cùng có 2 electron. Số proton trong nguyên tử magnesium là
Phát biểu nào sau đây là đúng khi nói về hình dạng của orbital nguyên tử?
Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 48, trong đó số hạt mang điện gấp đôi số hạt không mang điện. Nguyên tố Y là
Cho cấu trúc nguyên tử aluminium theo mô hình Rutherford – Bohr như sau:
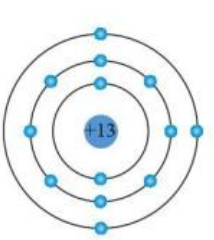
Lớp ngoài cùng của nguyên tử aluminium có bao nhiêu electron?
Theo mô hình nguyên tử Rutherford – Bohr, electron thuộc lớp nào sau đây có năng lượng thấp nhất?
Khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron ở khu vực đó là lớn nhất (khoảng 90%) gọi là