Các liên kết trong phân tử nitrogen (N2) được tạo thành là do sự xen phủ của
A. các orbital s với nhau và các orbital p với nhau.
B. 3 orbital p với nhau.
C. 1 orbital s và 2 orbital p với nhau.
D. 3 orbital p giống nhau về hình dạng và kích thước nhưng khác nhau về định hướng không gian với nhau.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: D
Cấu hình electron theo orbital của N (Z = 7): 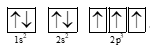
.
Mỗi nguyên tử N dùng một orbital 2pz (quy ước lấy trục z làm trục liên kết) để tạo liên kết giữa hai nguyên tử theo kiểu xen phủ trục tạo liên kết s.
Hai orbital còn lại (2px, 2py) sẽ xen phủ bên với nhau theo từng đôi một tạo ra hai liên kết p. Mỗi liên kết kí hiệu bằng một gạch nối, công thức cấu tạo của phân tử N2 có dạng liên kết ba: gồm một liên kết s và hai liên kết p.
Liên kết sigma (s) là loại liên kết cộng hóa trị được hình thành do
Liên kết cộng hóa trị được hình thành từ cặp electron dùng chung. Để tạo nên một cặp electron chung,
Khi hình thành phân tử giữa hai nguyên tử, vị trí của các AO như sau:
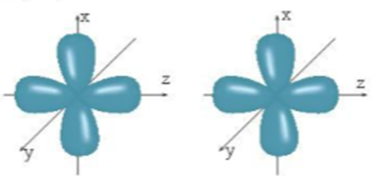
Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết s? Trong trường hợp nào sẽ tạo thành liên kết p?
Trong phân tử: CHCl=CHCl, số liên kết s và liên kết p lần lượt là