A. FeSO4.7H2O.
B. MgSO4.7H2O.
C.CuSO4.5H2O.
D.ZnSO4.2H2O.
 Giải bởi Vietjack
Giải bởi Vietjack
Bước 1:Tính \[{m_{RS{O_4}}}\] ban đầu, mddbão hòa
\[{m_{RSO4(bd)}} = \frac{{30}}{{100}}.160 = 48(gam)\]
- mdd bão hòa(sau khi kết tinh)= 160 - 28,552 = 131,478 gam
Bước 2:Tính mRSO4mRSO4 ở 20oC, mRSO4mRSO4 trong RSO4.nH2O bị kết tinh
- Ở 20oC: SRSO4= 35 gam, ta có:
mRSO4(dd 20oC)\[ = \frac{{35}}{{135}}.131,478 = 34,087gam\]
- Khối lượng RSO4trong RSO4.nH2O bị kết tinh là:
mRSO4 (kt)= mRSO4 (ban đầu)- mRSO4 (20 độ)= 48 - 34,087 = 13,913 gam
Bước 3:Biện luận tìm CTPT của muối ngậm nước
- Xét phân tử RSO4.nH2O ta có:
\[\frac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \frac{{R + 96}}{{18n}} = \frac{{13,913}}{{28,552 - 13,913}} \to R = 17,142n - 96\]
Biện luận:
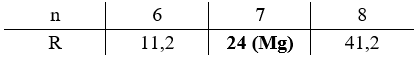
Vậy công thức của muối ngậm nước là MgSO4.7H2O.
Đáp án cần chọn là: B
FeSO4.7H2O + (NH4)2SO4→ FeSO4.(NH4)2SO4.6H2O + H2O
Cho độ tan của muối Mohr ở 200C là 26,9 g/100 g H2O và ở 800C là 73,0 g/100g H2O. Tính khối lượng của muối sắt(II) sunfat ngậm 7 nước cần thiết để tạo thành dung dịch muối Mohr bão hòa 800C, sau khi làm nguội dung dịch này xuống 200C để thu được 100 gam muối Mohr tinh thể và dung dịch bão hòa. Giả thiết trong quá trình kết tinh nước bay hơi không đáng kể.
Để xác định hàm lượng FeCO3trong quặng xiđerit, người ta làm như sau: Cân 0,6 gam mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4trong môi trường H2SO4loãng. Chuẩn độ dung dịch thu được bằng dung dịch chuẩn KMnO40,025M thì dùng vừa hết 25,2 ml. Phần trăm theo khối lượng của FeCO3là