Dạng 2: Tính khối lượng nguyên tử có đáp án
-
734 lượt thi
-
12 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Quan sát mô hình và cho biết khối lượng nguyên tử carbon là
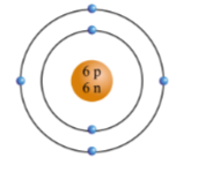
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử carbon có 6 proton và 6 neutron. Khối lượng nguyên tử carbon là:
6 × 1 + 6 × 1 = 12 (amu).
Câu 2:
Một nguyên tử nhôm (aluminium) có 13 proton; 13 electron và 14 neutron. Khối lượng nguyên tử nhôm này là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Do khối lượng electron nhỏ hơn nhiều lần khối lượng proton và neutron nên coi khối lượng nguyên tử bằng khối lượng của hạt nhân.
Khối lượng hạt nhân nguyên tử nhôm là:
13 × 1 + 14 × 1 = 27 (amu).
Câu 3:
Một nguyên tử sodium có 11 proton, 11 electron và 12 neutron. Khối lượng của nguyên tử sodium này là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Do khối lượng electron nhỏ hơn nhiều lần khối lượng proton và neutron nên coi khối lượng nguyên tử bằng khối lượng của hạt nhân.
Khối lượng nguyên tử sodium là: 11 × 1 + 12 × 1 = 23 amu.
Câu 4:
Trong các nguyên tử sau, nguyên tử nào có khối lượng nguyên tử lớn nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khối lượng nguyên tử Na là 23 amu.
Khối lượng nguyên tử O là 16 amu.
Khối lượng nguyên tử Ca là 40 amu.
Khối lượng nguyên tử H là 1 amu.
Vậy khối lượng nguyên tử Ca là lớn nhất.
Câu 5:
Cho mô hình nguyên tử sau:
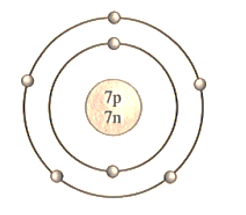
Khối lượng nguyên tử này là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Quan sát nguyên tử thấy được cấu tạo nên bởi: 7 proton; 7 neutron và 7 electron.
Khối lượng nguyên tử: 7 × 1 + 7 × 1 = 14 amu.
Câu 6:
Cho mô hình nguyên tử silicon như sau:
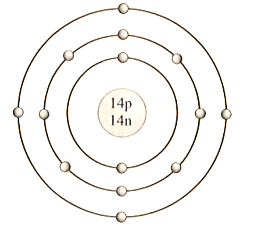
Nhận xét nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu A sai vì nguyên tử silicon có 3 lớp electron.
Phát biểu B sai vì vỏ nguyên tử silicon có 14 electron.
Phát biểu C sai vì hạt mang điện trong hạt nhân nguyên tử silicon là 14 hạt.
Phát biểu D đúng, khối lượng nguyên tử silicon là 14 × 1 + 14 × 1 = 28 amu.
Câu 7:
Tổng số proton, neutron và electron của nguyên tử X là 46. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14. Khối lượng nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi số hạt proton, neutron và electron trong nguyên tử X lần lượt là P, N và E.
Nguyên tử trung hòa về điện nên E = P (1)
Tổng số proton, neutron và electron của nguyên tử X là 46 nên:
P + N + E = 46 (2)
Thay E = P vào (2) ta được 2P + N = 46 hay N = 46 – 2P (3)
Trong X số hạt mang điện nhiều hơn số hạt không mang điện là 14 nên:
(P + E) – N = 14 (4)
Thay E = P; N = 46 – 2P vào (4) ta được:
2P – (46 – 2P) = 14 ⇒ P = 15 (= E)
Vậy N = 46 – 2.15 = 16.
Khối lượng nguyên tử X là: 15 . 1 + 16 . 1 = 31 (amu).
Câu 8:
Hạt nhân một nguyên tử fluorine có 9 proton và 10 neutron. Khối lượng của một nguyên tử flourine xấp xỉ bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Một cách gần đúng, coi khối lượng nguyên tử xấp xỉ bằng khối lượng của hạt nhân.
Khối lượng của nguyên tử fluorine = 9.1 + 10.1 = 19 (amu).
Câu 9:
Khối lượng của một nguyên tử oxygen bằng 26,5595.10-24 g. Khối lượng nguyên tử oxygen theo amu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
1 amu = 1,6605.10-24 g
Khối lượng của nguyên tử oxygen theo amu là:
Câu 10:
Tại sao nói khối lượng của nguyên tử chính là khối lượng của hạt nhân?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Proton và neutron có khối lượng xấp xỉ bằng nhau (gần bằng 1 amu). Electron có khối lượng rất bé (chỉ bằng khoảng 0,00055 amu), nhỏ hơn rất nhiều lần so với khối lượng của proton và neutron. Nên ta có thể coi khối lượng của nguyên tử chính là khối lượng của hạt nhân.
Câu 11:
Một nguyên tử carbon có khối lượng là 1,9926 × 10-23 gam. Khối lượng nguyên tử carbon tính theo đơn vị amu là ? (biết 1 amu = 1,6605×10-24 gam)
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khối lượng nguyên tử carbon tính theo đơn vị amu là:
Câu 12:
Cho các phát biểu sau:
(1) Trong mỗi nguyên tử, số hạt proton và electron luôn bằng nhau.
(2) Điện tích hạt nhân bằng tổng điện tích của các hạt proton trong nguyên tử.
(3) Khối lượng hạt nhân được coi là khối lượng nguyên tử.
(4) Proton và electron có khối lượng xấp xỉ bằng nhau.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu đúng: (1), (2), (3)
Phát biểu sai: (4)
Sửa phát biểu sai: Proton và neutron có khối lượng xấp xỉ bằng nhau (gần bằng 1 amu). Electron có khối lượng rất bé (chỉ bằng khoảng 0,00055 amu), nhỏ hơn rất nhiều lần so với khối lượng của proton và neutron.
