Đề thi Hóa 9 giữa kì 1 có đáp án (Đề 3)
-
2166 lượt thi
-
1 câu hỏi
-
20 phút
Danh sách câu hỏi
Câu 1:
(4 điểm)
Hòa tan hoàn toàn 4,8 gam magie trong 200 gam dung dịch H2SO4loãng.
a. Tính thể tích khí hiđro thoát ra ở đktc.
b. Tính nồng độ phần trăm của dung dịch H2SO4cần dùng.
c. Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
d. Dẫn lượng khí hiđro ở trên qua 4,8 gam Fe2O3nung nóng. Tính khối lượng sắt tạo thành (Biết hiệu suất phản ứng 100%).
 Xem đáp án
Xem đáp án
a. Số mol của Mg là: nMg= = 0,2 mol
= 0,2 mol
Phương trình phản ứng:
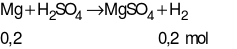
Theo phương trình phản ứng ta có: = 0,2 mol
= 0,2 mol
Suy ra thể tích khí H2thoát ra ở đktc là:
 = 0,2.22,4 = 4,48 lít
= 0,2.22,4 = 4,48 lít
b. Phương trình phản ứng:
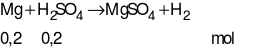
Suy ra = 0,2 mol;
= 0,2 mol; = 0,2.98 = 19,6 gam
= 0,2.98 = 19,6 gam
Vậy nồng độ phần trăm của dung dịch H2SO4cần dùng là:
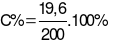 = 9,8%
= 9,8%
c. Ta có khối lượng dung dịch sau phản ứng là:
mdd sau phản ứng= 200 + 4,8 – 0,2.2 = 204,4 g
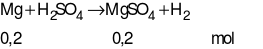
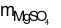 = 0,2.120 = 24 g
= 0,2.120 = 24 g
Suy ra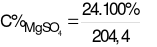 = 11,74%
= 11,74%
d. Số mol của Fe2O3là: = 0,03 mol
= 0,03 mol
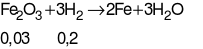
Xét tỉ lệ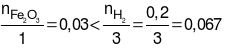
Suy ra Fe2O3hết, H2dư
Phương trình phản ứng:
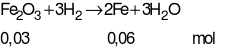
Vậy khối lượng sắt tạo thành là mFe= 0,06.56 = 3,36 gam.
