ĐGNL ĐHQG TP.HCM - Vấn đề thuộc lĩnh vực hóa học - Đồng vị
-
1248 lượt thi
-
39 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Đồng có 2 đồng vị \[{}_{29}^{63}Cu\] và \[{}_{29}^{65}Cu\]. Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm số nguyên tử của mỗi đồng vị là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi phần trăm đồng vị \[{}_{29}^{63}Cu\] là a%
=>phần trăm đồng vị \[{}_{29}^{65}Cu\] là (100 – a)%
Ta có :
\[\overline A = \frac{{63a + 65.\left( {100 - a} \right)}}{{100}} = 63,54\]
=>a = 73
Vậy phần trăm mỗi đồng vị là:
73% \[{}_{29}^{63}Cu\]và 27% \[{}_{29}^{65}Cu\]
Đáp án cần chọn là: A
Câu 2:
Agon tách ra từ không khí là hỗn hợp của 3 đồng vị: 99,6% 40Ar, 0,063% 38Ar, 0,337% 36Ar. Tính thể tích của 10 gam Ar ở điều kiện tiêu chuẩn.
 Xem đáp án
Xem đáp án
Trả lời:
Số khối:
\[{\overline A _{{\rm{Ar}}}} = \frac{{99,6.40 + 0,063.38 + 0,337.36}}{{100}} = 39,985\]
\[ \Rightarrow {n_{Ar}} = \frac{{10}}{{39,985}} = 0,25mol\]
=>V = 0,25.22,4 = 5,6L
Đáp án cần chọn là: A
Câu 3:
Khối lượng nguyên tử trung bình của bo (B) là 10,812. Số nguyên tử \[{}_5^{11}B\] khi có 94 nguyên tử \[{}_5^{10}B\] là
 Xem đáp án
Xem đáp án
Trả lời:
Ta có:
\[\overline M = \frac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}}\]
\[ \to \overline M = \frac{{{x_1}.10 + \left( {100 - {x_1}} \right).11}}{{100}} = 10,812\]
\[ \to {x_1} = 18,8\% \]
=>phần trăm số lượng của \[{}_5^{11}B\] là:
100% - 18,8% = 81,2%
=>tỉ lệ số nguyên tử \[\frac{{{}_5^{11}B}}{{{}_5^{10}B}} = \frac{{81,2}}{{18,8}}\]
=>số nguyên tử \[{}_5^{11}B\] khi có 94 nguyên tử \[{}_5^{10}B\] là:
\[94.\frac{{81,2}}{{18,8}} = 406\]
Đáp án cần chọn là: C
Câu 4:
Hai đồng vị có số khối trung bình 40,08 đvC. Hai đồng vị này có số nơtron hơn kém nhau là 2. Đồng vị có số khối nhỏ chiếm 96%. Số khối mỗi đồng vị là
 Xem đáp án
Xem đáp án
Trả lời:
Số khối trung bình 2 đồng vị:
A = 0,96.A1 + 0,04.A2 = 40,08
=>(Z + N).0,96 + (Z + N + 2).0,04 = 40,08
=>Z + N = 40
Vậy số khối 2 đồng vị lần lượt là 40 và 42 đvC
Đáp án cần chọn là: A
Câu 5:
Hiđro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị \[{}_1^2H\] trong 1 ml nước (cho rằng trong nước chỉ có 2 đồng vị \[{}_1^2H,{}_1^1H\]), cho M = 18, khối lượng riêng của nước là 1 g/ml ?
 Xem đáp án
Xem đáp án
Trả lời:
Áp dụng công thức: m = D.V
\[ \Rightarrow {m_{{H_2}O}} = 1gam\]
\[ \Rightarrow {n_{{H_2}O}} = \frac{1}{{18}}mol\]
=>số phân tử \[{H_2}O = \frac{{6,{{02.10}^{23}}}}{{18}} = 3,{34.10^{22}}\]
=>Tổng số nguyên tử H = 2 . số phân tử H2O
Đặt x và y lần lượt là số nguyên tử \[{}_1^2H,{}_1^1H\]
=>x + y = 6,68.1022
+) Nguyên tử khối trung bình của H là 1,008
Mà trong 6,68.1022 nguyên tử H gồm \[{}_1^2H,{}_1^1H\]
=>Khối lượng của 6,68.1022 nguyên tử H là:
2x + y = 1,008.6,68.1022
=>x = 5,344.1020 và y = 6,626.1022 nguyên tử
Đáp án cần chọn là: A
Câu 6:
Nguyên tử khối của B là 10,81. B gồm 2 đồng vị 10B và 11B. Phần trăm đồng vị 11B trong H3BO3 (biết MH = 1 và MO = 16) là
 Xem đáp án
Xem đáp án
Trả lời:
\[{\overline A _B} = \frac{{{x_1}.{A_1} + {x_2}.{A_2}}}{{100}}\]
\[ \to {\overline A _B} = \frac{{{x_1}.10 + \left( {100 - {x_1}} \right).11}}{{100}} = 10,81\]
\[ \to {x_1} = 19\% \]
+) Lấy 1 mol H3BO3 (61,81 gam) trong đó có chứa 1 mol B
=>có 0,19 mol 10B và 0,81 mol 11B
=>khối lượng 11B = 0,81.11 = 8,91
\[ \Rightarrow \% {m_{{{11}_B}}} = \frac{{{m_{{{11}_B}}}}}{{{m_{{H_3}P{O_3}}}}}.100\% \]
\[ \Rightarrow \% {m_{{{11}_B}}} = \frac{{8,91}}{{61,81}}.100\% \]
\[ \Rightarrow \% {m_{{{11}_B}}} = 14,42\% \]
Đáp án cần chọn là: B
Câu 7:
Một hỗn hợp gồm hai đồng vị có số khối trung bình 31,1 và có tỉ lệ phần trăm các đồng vị là 90% và 10%. Tổng số hạt trong hai đồng vị là 93 và tổng số hạt không mang điện bằng 0,55 lần tổng số hạt mang điện. Số nơtron của đồng vị có số khối lớn hơn là
 Xem đáp án
Xem đáp án
Trả lời:
Đặt đồng vị thứ nhất là \[{}_Z^{{A_1}}X\] có số nơtron là N1, đồng vị thứ 2 là \[{}_Z^{{A_2}}X\] có số nơtron là N2 (vì 2 đồng vị thuộc cùng 1 nguyên tố nên Z và E như nhau)
+) Số khối trung bình:
\[\overline A = \frac{{90.{A_1} + 10.{A_2}}}{{100}} = 0,9{A_1} + 0,1{A_2} = 31,1\]
Vì A = Z + N =>0,9.(Z + N1) + 0,1.(Z + N2) = 31,1
=>100Z + 90N1 + 10N2 = 3110 (1)
+) Tổng số các hạt trong 2 đồng vị là 93:
=>E + Z + N1 + E + Z + N2 = 93
=>(2Z + N1) + (2Z + N2) = 93
=>4Z + N1 + N2 = 93 (2)
+) Tổng số hạt không mang điện bằng 0,55 lần tổng số hạt mang điện
=>N1 + N2 = 0,55.(Z + E + Z + E)
=>N1 + N2 = 0,55.4Z = 2,2Z (3)
Từ (1), (2) và (3) =>Z = 15; N1 = 16; N2 = 17
Đáp án cần chọn là: B
Câu 8:
Một nguyên tử M có 75 electron và 110 nơtron. Kí hiệu của nguyên tử M là
 Xem đáp án
Xem đáp án
Trả lời:
M có 75e =>M có 75p hay Z = 75
=>Số khối của M là: A = p + n = 75 + 110 = 185
=>Kí hiệu của nguyên tử M là: \[{}_{75}^{185}M\]
Đáp án cần chọn là: C
Câu 9:
Nguyên tử X không có nơtron trong hạt nhân nguyên tử. Nguyên tử X là
 Xem đáp án
Xem đáp án
Trả lời:
Nguyên tử X không có nơtron trong hạt nhân nguyên tử. Nguyên tử X là \[{}_1^1H\]
Đáp án cần chọn là: A
Câu 10:
Nguyên tố X có 3 đồng vị là X1 chiếm 92,23%, X2 chiếm 4,67% và X3 chiếm 3,1%. Tổng số khối của 3 đồng vị bằng 87. Số nơtron trong X2 nhiều hơn X1 1 hạt. Nguyên tử khối trung bình của X là 28,0855. Số khối của X3 là
 Xem đáp án
Xem đáp án
Trả lời:
A = 92,23%.X1 + 4,67%.X2 + 3,1%.X3 = 28,0855
Tổng số khối = X1 + X2 + X3 = 87
X1 + 1 = X2
=>X1 = 28; X2 = 29; X3 = 30
Đáp án cần chọn là: C
Câu 11:
Trong tự nhiên, nguyên tố Clo có 2 đồng vị 35Cl và 37Cl có phần trăm số lượng tương ứng là 75% và 25%. Nguyên tố Cu có 2 đồng vị trong đó 63Cu chiếm 73% số lượng. Biết Cu và Cl tạo được hợp chất CuCl2 trong đó Cu chiếm 47,228% khối lượng. Đồng vị còn lại của Cu là
 Xem đáp án
Xem đáp án
Trả lời:
+) Ta có:
\[{\overline A _{Cl}} = \frac{{35,75 + 37,25}}{{100}} = 35,5\]
+) Gọi a là số khối trung bình của Cu
\[ \Rightarrow \% {m_{Cu}} = \frac{a}{{a + 35,5.2}}.100\% = 47,228\% \]
=>a = 63,54%
+) Đồng vị 63Cu chiếm 73%
=>đồng vị còn lại có số khối là x chiếm 27%
\[ \Rightarrow \frac{{63.73 + x.27}}{{100}} = 63,54\]
\[ \Rightarrow x = 65\]
Vậy đồng vị còn lại là 65Cu
Đáp án cần chọn là: C
Câu 12:
Nguyên tử nào trong các nguyên tử sau đây chứa đồng thời 20 nơtron, 19 proton và 19 electron:
 Xem đáp án
Xem đáp án
Trả lời:
Z = số p = số e = 19;
A = Z + N = 19 + 20 = 39
Kí hiệu hóa học của nguyên tử đó là: \[{}_{19}^{39}K\]
Đáp án cần chọn là: A
Câu 13:
Trong tự nhiên cacbon có 2 đồng vị bền \[{}_6^{12}C\] và \[{}_6^{13}C\]. Nguyên tử khối trung bình của cacbon là 12,011. Phần trăm của hai đồng vị trên là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi phần trăm số nguyên tử của 12C là x % và 13C là y%
Ta có hệ phương trình:
\[\left\{ {\begin{array}{*{20}{c}}{x + y = 100}\\{\frac{{12x + 3y}}{{100}} = 12,011}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{c}}{x = 98,9\% }\\{y = 1,1\% }\end{array}} \right.\]
Đáp án cần chọn là: A
Câu 14:
Trong tự nhiên Li có 2 đồng vị là 6Li và 7Li và có nguyên tử khối trung bình là 6,94. Phần trăm khối lượng 7Li trong LiNO3 là (cho N = 14; O = 16)
 Xem đáp án
Xem đáp án
Trả lời:
Gọi phần trăm số nguyên tử của 6Li là x % và 7Li là y%
Ta có hệ phương trình:
\[\left\{ {\begin{array}{*{20}{c}}{x + y = 100}\\{\frac{{6x + 7y}}{{100}} = 6,94}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{c}}{x = 6\% }\\{y = 94\% }\end{array}} \right.\]
Trong 1 mol LiNO3 có chứa: 0,94 mol 7Li
\[\% {m_{{7_{Li}}}} = \frac{{0,94.7}}{{6,94 + 14 + 16.3}}.100\% = 9,545\% \]
Đáp án cần chọn là: D
Câu 15:
Trong tự nhiên brom có hai đồng vị là \[{}_{35}^{79}Br\] và \[{}_{35}^{81}Br\], nguyên tử khối trung bình của brom là 79,986. Nếu nguyên tử khối mỗi đồng vị có giá trị bằng số khối thì tỉ lệ % số nguyên tử đồng vị \[{}_{35}^{79}Br\] là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi phần trăm số nguyên tử của là x % và là y%
Ta có hệ phương trình:
\[\left\{ {\begin{array}{*{20}{c}}{x + y = 100}\\{\frac{{79x + 81y}}{{100}} = 79,986}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{c}}{x = 50,7\% }\\{y = 49,3\% }\end{array}} \right.\]
Đáp án cần chọn là: B
Câu 16:
Bo là nguyên tố dinh dưỡng thiết yếu đối với cây trồng. Ngày nay trên 70 quốc gia đã được phát hiện tình trạng thiếu Bo ở hầu hết các loại cây trên nhiều loại đất. Phân Bo cũng đã được sử dụng rộng rãi trên thế giới. Trong tự nhiên, Bo có 2 đồng vị . Biết \[{}_5^{10}B\] chiếm 18,8%. Khối lượng nguyên tử trung bình của bo là 10,812. Số khối của đồng vi ̣thứ 2 là
 Xem đáp án
Xem đáp án
Trả lời:
Theo đề bài ta có:
\[10,812 = \frac{{18,8.10 + 81,2.{A_2}}}{{100}}\]
\[ \to {A_2} = 11\]
Đáp án cần chọn là: D
Câu 17:
 Xem đáp án
Xem đáp án
Trả lời:
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân( số proton, số nơtron)
Đáp án cần chọn là: D
Câu 18:
 Xem đáp án
Xem đáp án
Trả lời:
Các đồng vị của cùng một nguyên tố hóa học được phân biệt bởi số nơtron.
Đáp án cần chọn là: D
Câu 19:
Nguyên tử khối trung bình của Cu là 63,546. Đồng tồn tại trong tự nhiên với 2 loại đồng vị là \[{}_{29}^{65}Cu\] và \[{}_{29}^{63}Cu\]. Thành phần phần trăm về nguyên tử của \[{}_{29}^{63}Cu\] là:
 Xem đáp án
Xem đáp án
Trả lời:
Gọi phần trăm số nguyên tử của 65Cu và 63Cu lần lượt là x và y (%)
Theo đề bài ta có:
\[\left\{ {\begin{array}{*{20}{c}}{x + y = 100}\\{\frac{{65x + 63y}}{{100}} = 63,546}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{c}}{x = 27,3}\\{y = 72,7}\end{array}} \right.\]
Đáp án cần chọn là: A
Câu 20:
Nguyên tử khối trung bình của nguyên tố R là 79,91. R có 2 đồng vị. Biết 79R chiếm 54,5%, Nguyên tử khối của đồng vị còn lại có giá trị nào ?
 Xem đáp án
Xem đáp án
Trả lời:
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình:
\[\overline A = \frac{{79.54,5 + A.45,5}}{{100}} = 79,91\]
\[ \to A = 81\]
Đáp án cần chọn là: C
Câu 21:
Cabon trong tự nhiên là hỗn hợp của hai đồng vị 12C và 13C, trong đó đồng vị 12C chiếm 98,89%. Biết rằng đồng vị cacbon 13C có nguyên tử khối bằng 12,991. Nguyên tử khối trung bình của cacbon là
 Xem đáp án
Xem đáp án
Trả lời:
\[{\overline M _C} = \frac{{12.98,89 + 12,991.\left( {100 - 98,89} \right)}}{{100}} = 12,011\]
Đáp án cần chọn là: C
Câu 22:
Trong tự nhiên, bạc có 2 đồng vị là 109Ag (chiếm 44%) và AAg. Biết khối lượng nguyên tử trung bình của Ag là 107,88. Số khối A của đồng vị thứ 2 là:
 Xem đáp án
Xem đáp án
Trả lời:
Phần trăm số nguyên tử AAg là 100% - 44% = 56%
Khối lượng nguyên tử trung bình:
\[\overline A = \frac{{x.{A_1} + y.{A_2}}}{{100}}\]
\[ \to 107,88 = \frac{{44.109 + 56.A}}{{100}}\]
→ A = 107
Đáp án cần chọn là: C
Câu 23:
Nguyên tố Mg có 3 loại đồng vị có số khối lần lượt là: 24, 25 và 26. Trong 5000 nguyên tử Mg thì có 3930 đồng vị 24, 505 đồng vị 25, còn lại là đồng vị 26. Hãy tính khối lượng nguyên tử trung bình của Mg.
 Xem đáp án
Xem đáp án
Trả lời:
% Mg ( 24 ) = 3930 : 5000 . 100% = 78,6 %
% Mg ( 25 ) = 505 : 5000 . 100% = 10,1 %
% Mg ( 26 ) = 100 – 78,6 – 10,1 = 11,3 %
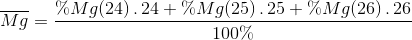
= 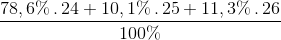
= 24,327
Đáp án cần chọn là: D
Câu 24:
Nguyên tố clo có 2 đồng vị bền 35Cl chiếm 75,77% và 37Cl chiếm 24,23%. Tính nguyên tử khối trung bình của Cl là:
 Xem đáp án
Xem đáp án
Trả lời:
Áp dụng công thức tính nguyên tử khối trung bình:
\[{\overline A _X} = \frac{{A.x + B.y}}{{100}}\]
Trong đó đồng vị A có x% số nguyên tử, đồng vị B có y% số nguyên tử.
Vậy nguyên tử khối trung bình của nguyên tố clo bằng:
\[{\overline A _{Cl}} = \frac{{35.75,77 + 37.24,23}}{{100}} = 35,48\]Đáp án cần chọn là: A
Câu 25:
Nguyên tử khối trung bình của đồng là 63,546. Trong tự nhiên đồng có hai đồng vị 63Cu và 65Cu. Tính % số nguyên tử của đồng vị 65Cu?
 Xem đáp án
Xem đáp án
Trả lời:
Gọi % số nguyên tử của đồng vị 65Cu là x% thì % số nguyên tử của đồng vị 63Cu là (100-x)%
Nguyên tử khối trung bình của đồng được tính bằng công thức:
\[{\overline A _{Cu}} = \frac{{65x + 63.\left( {100 - x} \right)}}{{100}} = 63,546\]
Giải phương trình trên ta có x= 27,3
Vậy % số nguyên tử của đồng vị 65Cu là 27,3%
Đáp án cần chọn là: A
Câu 26:
Trong tự nhiên clo có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của Clo là 35,5. Tính thành phần % khối lượng của 37Cl trong KClO3 (cho K = 39; O=16)?
 Xem đáp án
Xem đáp án
Trả lời:
Giả sử % số nguyên tử của đồng vị 37Cl là x%, suy ra % số nguyên tử đồng vị 35Cl là (100-x)%
Nguyên tử khối trung bình của Clo được tính theo công thức:
\[{\overline A _{Cl}} = \frac{{37x + 35\left( {100 - x} \right)}}{{100}} = 35,5\]
Giải phương trình trên được x= 25%
Vậy % khối lượng của 37Cl trong KClO3 là:
\[\% {m_{37Cl}} = \frac{{0,25.37.100\% }}{{39 + 35,5 + 16.3}} = 7,55\% \]
Đáp án cần chọn là: B
Câu 27:
Nitơ trong tự nhiên là hỗn hợp gồm 2 động vị là 14N (99,63%) và 15N (0,37%)Nguyên tử khối trung bình của nitơ là:
 Xem đáp án
Xem đáp án
Trả lời:
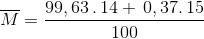
= 14,0037
=>Đáp án B
Đáp án cần chọn là: B
Câu 28:
 Xem đáp án
Xem đáp án
Trả lời:
Nước có công thức : H2O : phân tử khối của nước lớn nhất khi phân tử khối của H và O là lớn nhất
=> 3H và 18O là lớn nhất =>M H2O = 3 . 2 + 18 = 24
Đáp án cần chọn là: D
Câu 29:
Nguyên tố Bo có 2 đồng vị bền là 11B (x1 %) và 10B (x2 %), nguyên tử khối trung bình của Bo là 10,8. Giá trị của x1 % là:
 Xem đáp án
Xem đáp án
Trả lời:
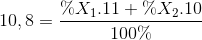
%X1 + %X2= 100 %
=> %X1 = 80% ; %X2 = 20%
Đáp án cần chọn là: A
Câu 30:
Trong thiên nhiên Ag có 2 đồng vị, đồng vị 44Ag107(56%). Tính số khối của đồng vị thứ hai. Biết nguyên tử khối trung bình của Ag là 107,88.
 Xem đáp án
Xem đáp án
Trả lời:
% của đồng vị còn lại là : 100 % - 56 % = 44 %
=>
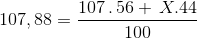
=>X = 109
=>Đáp án A
Đáp án cần chọn là: A
Câu 31:
Nguyên tử khối trung bình của rubiđi là 85,559. Trong tự nhiên rubidi có 2 đồng vị 85Rb và 87Rb. Xác định thành phần % số nguyên tử của đồng vị 85Rb?
 Xem đáp án
Xem đáp án
Trả lời:
Gọi % số nguyên tử của đồng vị 85Rb là x %, suy ra % số nguyên tử của đồng vị 87Rb là (100-x)%
Nguyên tử khối trung bình của rubiđi là 85,559 được tính theo công thức:
\[{\overline A _{Rb}} = \frac{{85x + 87\left( {100 - x} \right)}}{{100}} = 85,559\]
Giải phương trình trên ta được x = 72,05
Vậy thành phần % số nguyên tử của đồng vị 85Rb là 72,05%
Đáp án cần chọn là: D
Câu 32:
Trong tự nhiên brom có 2 đồng vị bền: 79Br chiếm 50,69% số nguyên tử và 81Br chiếm 49,31% số nguyên tử. Nguyên tử khối trung bình của brom bằng:
 Xem đáp án
Xem đáp án
Trả lời:
Nguyên tử khối trung bình của brom bằng:
\[{\overline A _{Br}} = \frac{{79.50.69 + 81.49,31}}{{100}} = 79,99\]
Đáp án cần chọn là: A
Câu 33:
X: 20 proton và 20 nơtron.
Y: 18 proton và 22 nơtron.
Z: 20 proton và 22 nơtron.
Những nguyên tử là các đồng vị của cùng một nguyên tố là:
 Xem đáp án
Xem đáp án
Trả lời:
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số notron, do đó số khối A của chúng khác nhau.
Vậy nguyên tử X và Z là các đồng vị của cùng một nguyên tố.
Đáp án cần chọn là: B
Câu 34:
 Xem đáp án
Xem đáp án
Trả lời:
Kí hiệu hóa học của nguyên tố là \[{}_Z^AX\] với A là số khối, Z là số hiệu nguyên tử.
Nguyên tử nguyên tố Clo có Z= 17 và A= N + Z= 17+20= 37.
Vậy kí hiệu nguyên tử clo là\[{}_{17}^{37}Cl\]
Đáp án cần chọn là: C
Câu 35:
Trong tự nhiên hiđro có 2 đồng vị bền là 1H, 2H; clo có hai đồng vị bền là 35Cl, 37Cl. Số loại phân tử HCl khác nhau có thể tạo thành từ các đồng vị trên là bao nhiêu?
 Xem đáp án
Xem đáp án
Trả lời:
Các loại phân tử HCl khác nhau có thể tạo thành từ các đồng vị trên là 1H35Cl; 1H37Cl; 2H35Cl; 2H37Cl
Vậy có 4 loại phân tử HCl khác nhau có thể được tạo thành.
Đáp án cần chọn là: B
Câu 36:
Khối lượng Nguyên tử trung bình của Brom là 79,91. Brom có 2 đồng vị trong đó đồng vị 79Br chiểm 54,5%. Số khối của đồng vị thứ 2 sẽ là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi A2 là số khối của nguyên tử dồng vị thứ 2.
Ta có:
\[\frac{{79.54,5 + {A_2}\left( {100 - 54,5} \right)}}{{100}} = 79,91\]
=>4305,5 + 45,5A2 = 7991
=>45,5A2 = 7991 − 4305,5
=>45,5A2 = 3685,5
=>A2 = 81
Đáp án cần chọn là: D
Câu 37:
Nguyên tố Bo có 2 đồng vị 10B ( x1 %) và 11B ( x2 %) nguyên tử khối trung bình của B là 10,8. x1 là
 Xem đáp án
Xem đáp án
Trả lời:
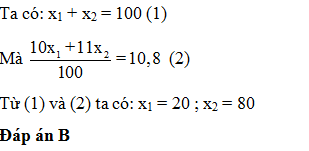
Đáp án cần chọn là: B
Câu 38:
Nguyên tử khối trung bình của Sb là 121,76. Sb có 2 đồng vị biết 121Sb chiếm 62% . Số khối của đồng vị thứ 2 là:
 Xem đáp án
Xem đáp án
Trả lời:
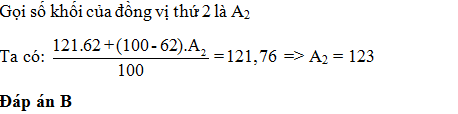
Đáp án cần chọn là: B
Câu 39:
Nguyên tử khối trung bình của đồng là 63,546. Trong tự nhiên nguyên tố đồng có hai đồng vị 63Cu và 65Cu. Tính % số nguyên tử của đồng vị 65Cu?
 Xem đáp án
Xem đáp án
Trả lời:
Gọi % số nguyên tử của đồng vị 63Cu là x%, gọi % số nguyên tử của đồng vị 65Cu là y%.
Nguyên tử khối trung bình của đồng là:
\[{\overline A _{Cu}} = \frac{{63x + 65y}}{{100}} = 63,546\]
Suy ra 63x + 65y= 63,546.100= 6354,6 (1)
Mặt khác x + y =100 (2)
Giải hệ trên ta có x = 72,7 và y = 27,3
Vậy % số nguyên tử của đồng vị 65Cu là 27,3%
Đáp án cần chọn là: A
