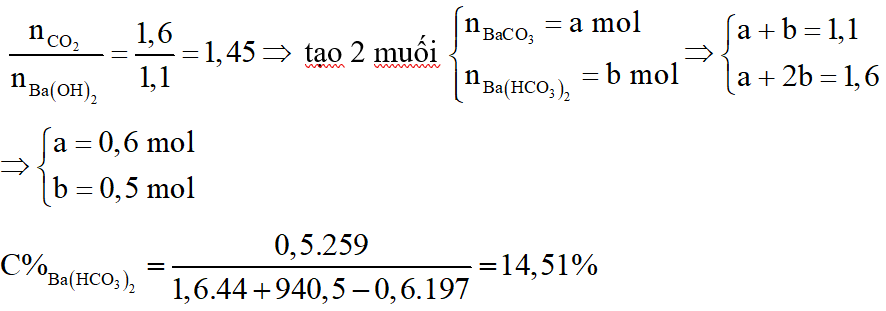Trắc nghiệm tổng hợp Hóa 9 Chương 2: Các loại hợp chất vô cơ có đáp án - Đề 7
-
2062 lượt thi
-
10 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hoàn thành sơ đồ biến hóa sau: (ghi rõ điều kiện nếu có; mỗi mũi tên là 1 phản ứng)
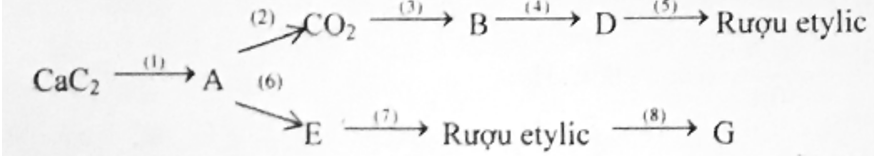
(Biết A, B, D, E, G là các chất hữu cơ; G có trong thành phần của giấm ăn)
 Xem đáp án
Xem đáp án
G có trong thành phần của giấm ăn nên G là CH3COOH (axit axetic)
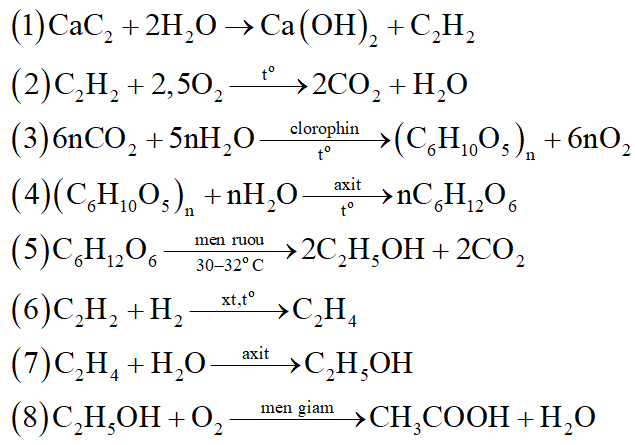
Câu 2:
Hỗn hợp X gồm hai hidrocacbon mạch hở, trong phân tử ngoài các liên kết đơn chỉ chứa thêm 1 liên kết đôi. Đốt cháy hoàn toàn 4,48 lít hỗn hợp X thu được 10,08 lít CO2. Biết số mol của hidrocacbon có số nguyên tử cacbon lớn hơn chiếm 25% tổng số mol của hỗn hợp, thể tích các khí đo ở đktc.
a. Tìm công thức phân tử của 2 hidrocacbon.
b. Trùng hợp hoàn toàn 4,48 lít đ X trên thu được bao nhiêu am polime?
 Xem đáp án
Xem đáp án
a. Số mol các chất là:
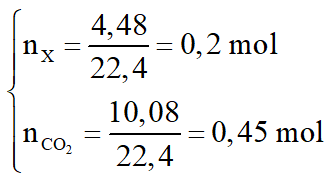
Đặt công thức chung của hai hidrocacbon là
Sơ đồ phản ứng đốt cháy X:
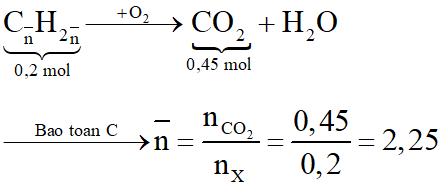
vậy nnhỏ = 2(C2H4)
Gọi công thức của hidrocacbon lớn là CmH2m
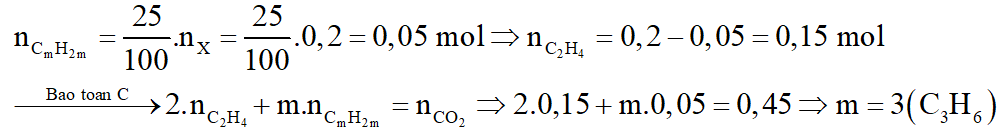
b.
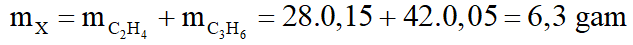
Phương trình phản ứng:
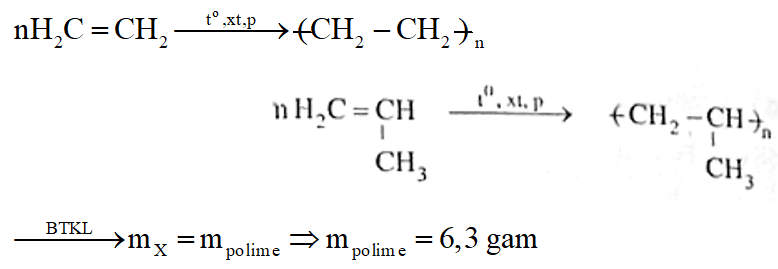
Câu 3:
Cho biết tổng số hạt proton, notron, electron trong hai nguyên tử của hai nguyên tố a và B là 78, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 26 hạt. Tỉ lệ số hạt mang điện trong A so với số hạt mang điện trong B là 10 : 3.
a. Tìm 2 nguyên tố A và B.
b. Hợp chất của A với D khi hòa tan trong nước cho dung dịch có tính kiềm. Hợp chất của B với D khi hòa tan trong nước cho dung dịch E có tính axit yếu. Hợp chất G chứa đồng thời cả A, B, D không tan trong nước nhưng tan trong dung dịch E. Xác định hợp chất tạo bởi A với D, B với D và G. Viết phương trình phản ứng.
 Xem đáp án
Xem đáp án
a. Gọi ZA, NA lần lượt là số proton, notron của A. Vậy số electron của A là ZA.
Gọi ZB, NB lần lượt là số proton, notron của B. Vậy số electron của B là ZB.
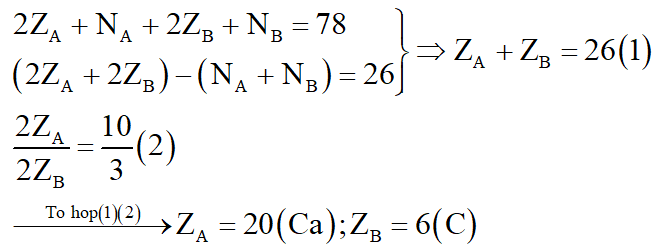
b. Hợp chất của A với D tan trong nước cho dung dịch có tính kiềm nên suy ra hợp chất đó là CaO:
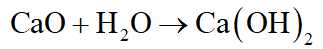
Hợp chất của B với D khi hòa tan trong nước cho dung dịch E có tính axit yếu nên suy ra hợp chất đó là CO2:
Hợp chất G là CaCO3:
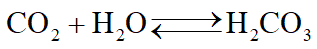
Câu 4:
Chỉ dùng một hóa chất (không dùng các chất đã nhận biết được làm thuốc thử), hãy trình bày phương pháp hóa học để nhận biết các dung dịch riêng biệt sau: HCl; H2SO4; NaNO3; Na2CO3. Nêu hiện tượng và viết phương trình phản ứng (nếu có).
 Xem đáp án
Xem đáp án
Dùng dung dịch Ba(HCO3)2
+ Dung dịch nào có khí bay ra, không tạo kết tủa là HCl
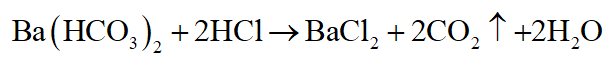
+ Dung dịch nào có khí bay ra, đồng thời tạo kết tủa là H2SO4.
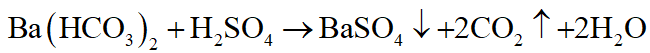
+ Dung dịch nào không có khí bay ra, chỉ tạo kết tủa là Na2CO3.
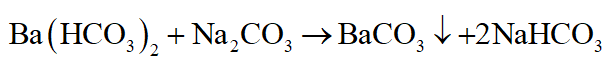
*Nhận xét:
Nguyên tử được cấu tạo từ proton (mang điện dương), nơtron (không mang điện) và electron (mang điện âm).
Nguyên tử trung hòa về điện nên suy ra số proton = số electron.
HCl, H2SO4, HNO3 là các axit mạnh; H2CO2, H2S, H2SO3 là các axit yếu.
Câu 5:
Hòa tan 54,4 gam hỗn hợp X gồm Fe và FeO vào dung dịch H2SO4 loãng, sau đó làm bay hơi dung dịch người ta thu được 222,4 gam chất rắn FeSO4.7H2O. Viết phương trình phản ứng và tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X. Biết các phản ứng xảy ra hoàn toàn.
 Xem đáp án
Xem đáp án
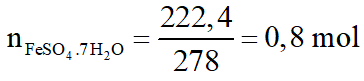
Các phương trình phản ứng:
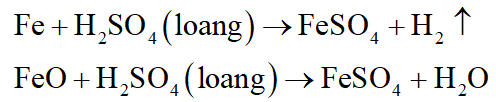
Đặt số mol các chất trong X là: Fe: x mol; FeO: y mol.
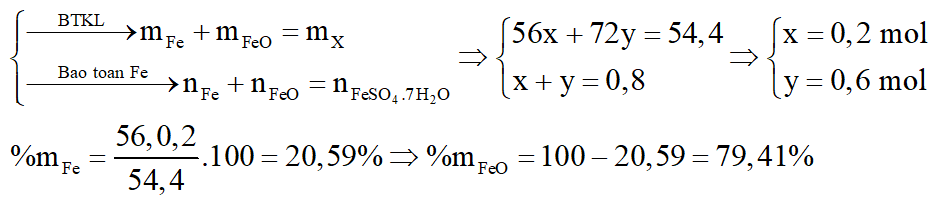
Câu 6:
Hỗn hợp X có khối lượng 28,11 gam gồm hai muối vô cơ R2CO3 và RHCO3. Chia X thành 3 phần bằng nhau:
- Phần 1 hòa tan trong nước rồi cho tác dụng hoàn toàn với dung dịch Ba(OH)2 dư, thu được 21,67 gam kết tủa.
- Phần 2 nhiệt phân một thời gian, thu được chất rắn có khối lượng giảm nhiều hơn 3,41 gam so với hỗn hợp ban đầu.
- Phần 3 hòa tan trong nước và phản ứng được tối đa với V ml dung dịch KOH 1M, đun nóng. Viết phương trình phản ứng và tính giá trị V.
 Xem đáp án
Xem đáp án
Các phương trình phản ứng:
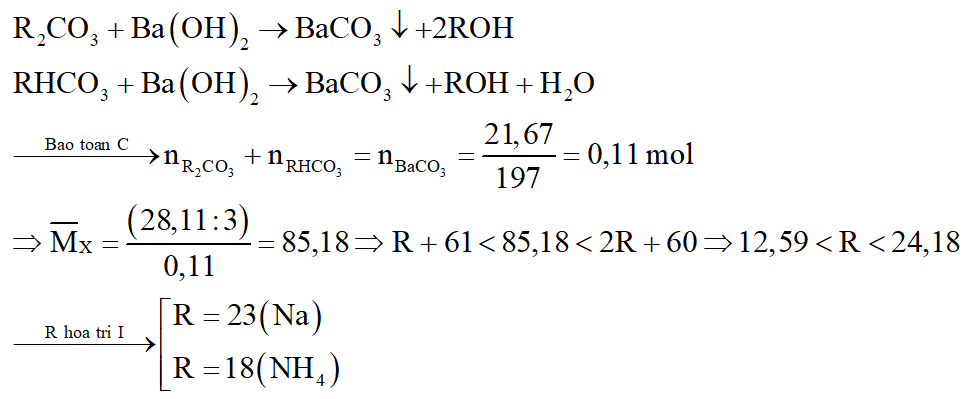
Giả sử phản ứng nhiệt phân xảy ra hoàn toàn:
Na2CO3 (không bị nhiệt phân)
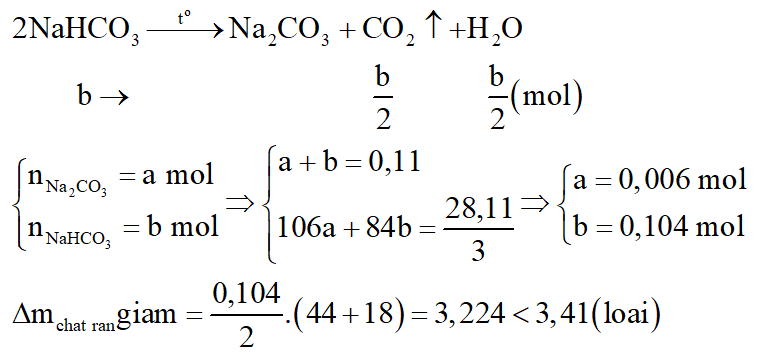
Vậy 2 muối là (NH4)2CO3 và NH4HCO3
Phương trình phản ứng:
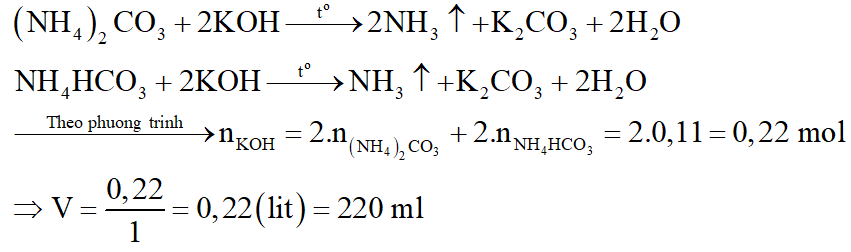
*Nhận xét:
Muối amoni (muối chứa gốc NH4) đều không bền nhiệt.
Thí dụ:
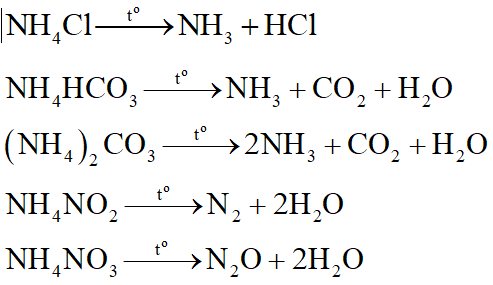
- Muối cacbonat của kim loại kiềm (Li, Na, K, Rb, Cs) đều bền nhiệt:

- Muối cacbonat của các kim loại còn lại đều bị nhiệt phân
Thí dụ:
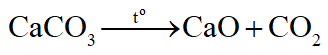
Muối hiđrocacbonat của tất cả các kim loại đều bị nhiệt phân, chúng bị nhiệt phân khi đun sôi dung dịch hoặc ở trạng thái rắn.
Thí dụ:
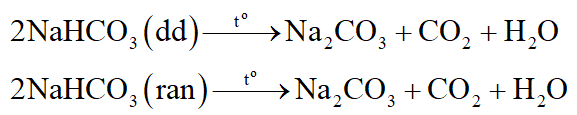
Câu 7:
 Xem đáp án
Xem đáp án
Phương trình phản ứng:
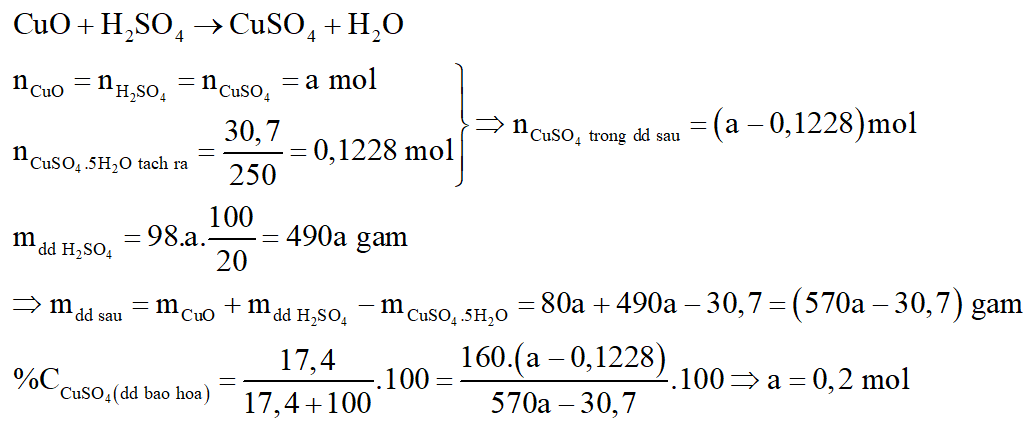
*Nhận xét:
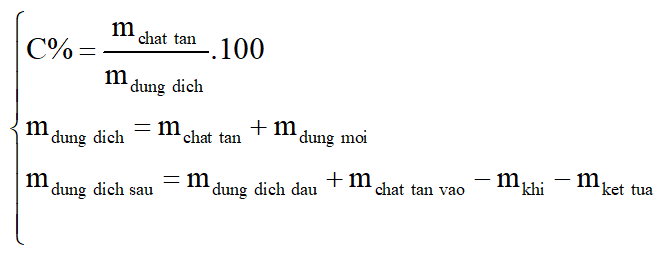
Độ tan (S) là số gam chất tan trong 100 gam nước:
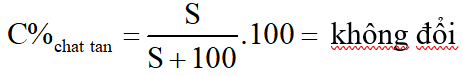
Câu 8:
Đốt cháy hoàn toàn m gam chất béo X chứa hỗn hợp các este có công thức (RCOO)3C3H5 và các axit béo RCOOH với R là C17H35 hoặc C15H31. Sau phản ứng thu được 13,44 lít CO2 (đktc) và 10,44 gam nước. Xà phòng hóa m gam chất béo X (hiệu suất phản ứng 90%) thì thu được bao nhiêu gam glixerol (glixerin)?
 Xem đáp án
Xem đáp án
Gọi công thức của este là CnH2n-4O6: a mol; của axit béo là CmH2mO2: b mol
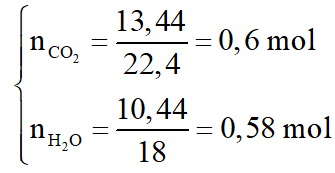
Sơ đồ phản ứng:
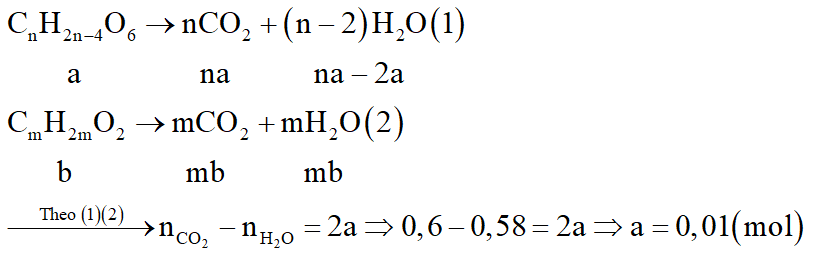
Xét giai đoạn xà phòng hóa X:
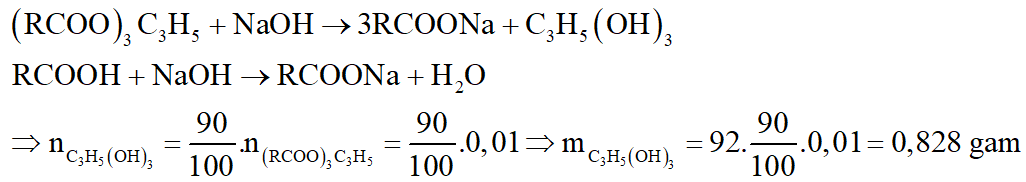
*Nhận xét:
Công thức tổng quát của mọi hợp chất hữu cơ chứa C, H hoặc C, H, O là CnH2n+2-2kOz
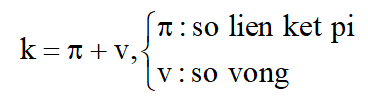
1 liên kết đôi chứa 1 liên kết pi.
1 liên kết ba chứa 2 liên kết pi.
Công thức tính độ bão hòa k đối với hợp chất hữu cơ CxHy hoặc CxHyOz:
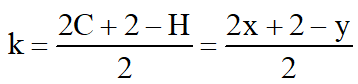
trong đó

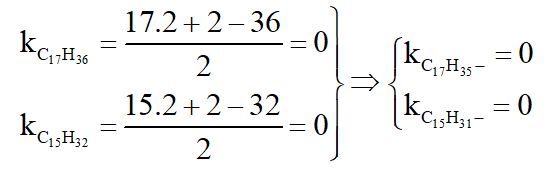
Câu 9:
Hòa tan hoàn toàn 42,4 gam hỗn hợp X gồm FexOy và Cu bằng dung dịch H2SO4 đặc nóng, vừa đủ thu được dung dịch Y chỉ chứa 93,6 gam hỗn hợp hai muối sunfat trung hòa và 4,48 lít khí SO2 (sản phẩm khử duy nhất ở đktc)
a. Xác định công thức phân tử của FexOy.
b. Cho 42,4 gam X vào dung dịch HCl dư. Sau phản ứng còn lại m gam chất rắn không tan. Tính m.
 Xem đáp án
Xem đáp án
a. Gọi
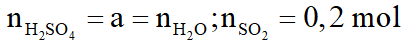
Bảo toàn khối lượng:
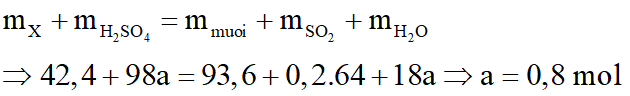
*Trường hợp 1:
Y chứa
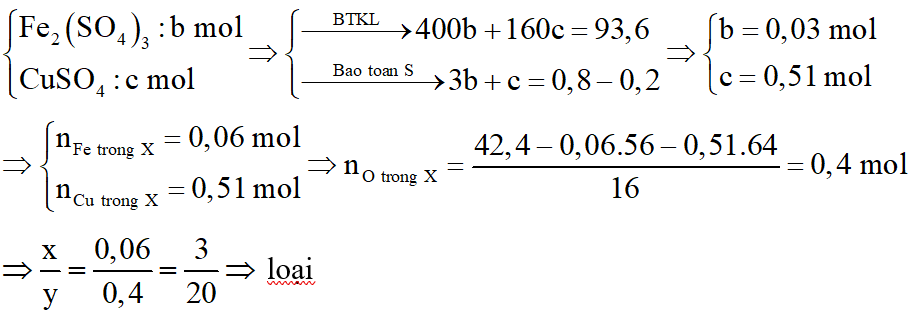
*Trường hợp 2:
Y chứa:
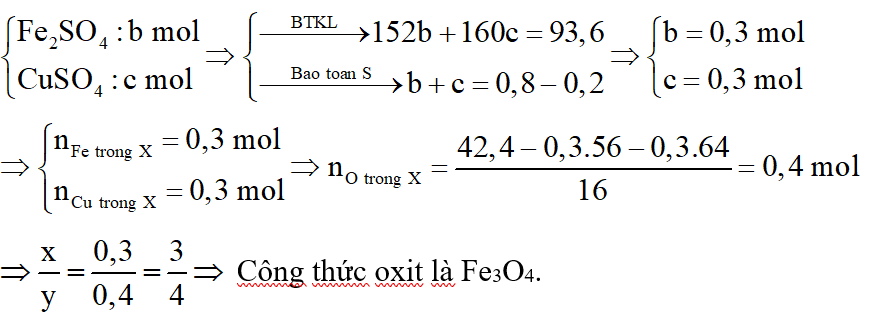
b.
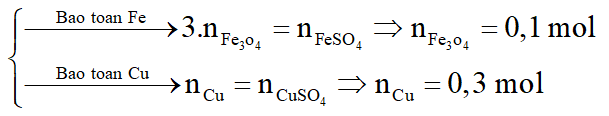
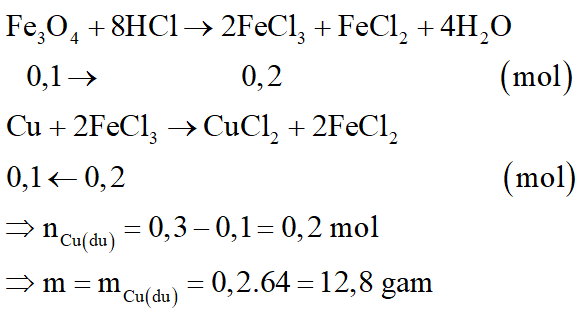
*Nhận xét: Chú ý một số phản ứng đặc biệt sau:
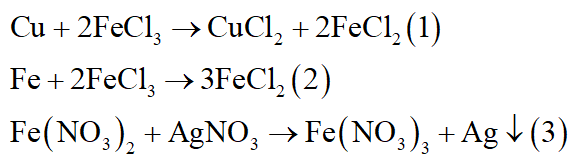
Các phản ứng (1), (2) áp dụng các muối Fe(III) tan như FeCl3, Fe2(SO4)3…
Câu 10:
Hỗn hợp A gồm hai axit cacboxylic no, đơn chức mạch hở có công thức dạng CnH2nO2 có phân tử khối hơn kém nhau 28. Lấy m gam hỗn hợp A cho phản ứng với Na dư, thu được 6,72 lít khí H2 (đktc). Mặt khác đốt cháy m gam hỗn hợp A, dẫn toàn bộ sản phẩm cháy chỉ gồm CO2 và H2O qua 1 bình chứa P2O5 dư, sau đó cho qua bình 2 chứa 940,5 gam dung dịch Ba(OH)2 20%. Sau phản ứng khối lượng bình 1 tăng 28,8 gam, bình 2 được dung dịch B và kim loại có khí đi ra khỏi bình 2. Biết các phản ứng xảy ra hoàn toàn.
a. Tính m.
b. Xác định công thức phân tử của mỗi axit.
c. Tính thành phần phần trăm theo khối lượng của mỗi axit trong hỗn hợp A.
d. Tính nồng độ % của chất tan trong dung dịch B.
 Xem đáp án
Xem đáp án
a.
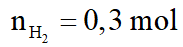
Gọi công thức trung bình của 2 axit là:
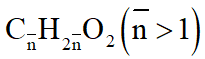
Sơ đồ phản ứng:
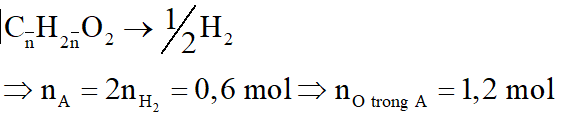
Sản phẩm cháy gồm CO2 và H2O cho hấp thụ qua bình 1 thì H2O bị hấp thụ, bình 2 hấp thụ CO2:
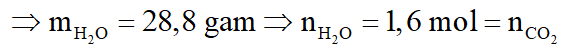
Bảo toàn khối lượng:
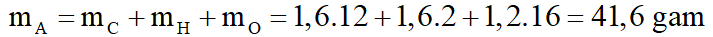
b. Ta có:
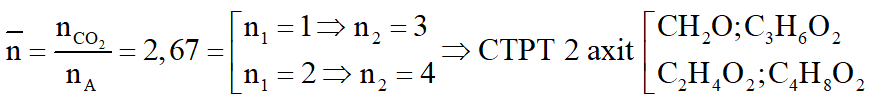
c.
*Trường hợp 1:
Gọi số mol
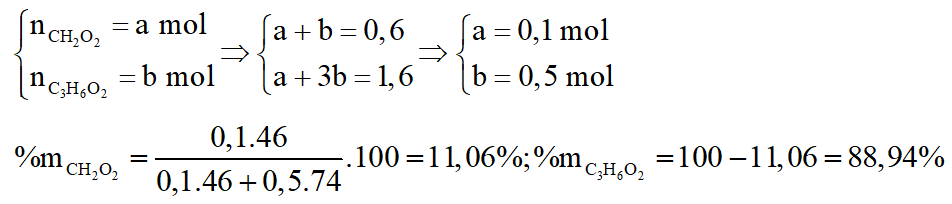
*Trường hợp :
Gọi số mol
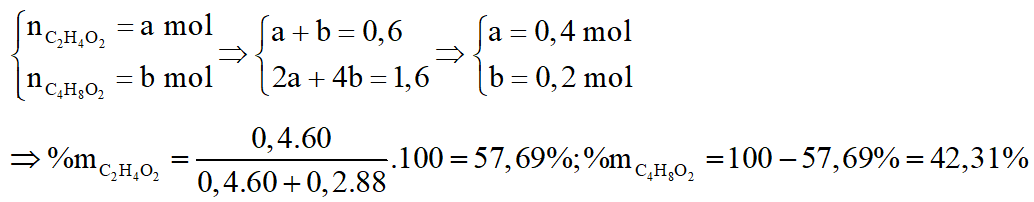
d.
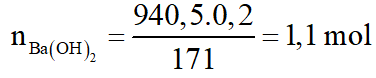
Ta có: