ĐGNL ĐHQG TP.HCM - Vấn đề thuộc lĩnh vực hóa học - Phản ứng oxi hóa - khử
-
514 lượt thi
-
20 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho amoniac NH3 tác dụng với oxi ở nhiệt độ cao có xúc tác thích hợp sinh ra nitơ oxit NO và nước. Phương trình hoá học: 4NH3 + 5O2 → 4NO + 6H2O. Trong phản ứng trên, NH3 đóng vai trò
 Xem đáp án
Xem đáp án
Trả lời:
\[4\mathop N\limits^{ - 3} {H_3} + 5\mathop {{O_2}}\limits^0 \to 4\mathop N\limits^{ + 2} \mathop O\limits^{ - 2} + 6{H_2}O\]
Quá trình cho – nhận e của N:
\[\mathop N\limits^{ - 3} {H_3} \to \mathop N\limits^{ + 2} O + 5e\]
=>NH3 đóng vai trò là chất khử.
Đáp án cần chọn là: B
Câu 2:
Cho phương trình hóa học : 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3. Kết luận nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Trả lời:
\[4\mathop {Fe}\limits^{ + 2} {\left( {OH} \right)_2} + \mathop {{O_2}}\limits^0 + 2{H_2}O \to 4\mathop {Fe}\limits^{ + 3} \mathop {{{\left( {OH} \right)}_3}}\limits^{ - 2} \]
Quá trình cho – nhận e:
\[\mathop {Fe}\limits^{ + 2} \to \mathop {Fe}\limits^{ + 3} + 1e\] =>Fe(OH)2 là chất khử
\[\mathop {{O_2}}\limits^0 + 4e \to 2\mathop O\limits^{ - 2} \] =>O2 là chất oxi hóa
Đáp án cần chọn là: B
Câu 3:
Cho ba phản ứng hóa học dưới đây
1) 2Na + 2H2O → 2NaOH + H2↑
2) CO2 + Ca(OH)2 → CaCO3↓ + H2O
3) 2KClO3 \[\mathop \to \limits^{t^\circ } \] 2KCl + 3O2
Các phản ứng oxi hóa khử là
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng oxi hóa – khử làm thay đổi số oxi hóa của các chất
=>có 2 phản ứng oxi hóa khử là
1) \[2\mathop {Na}\limits^0 + 2\mathop {{H_2}O}\limits^{ + 1} \to 2\mathop {NaOH + }\limits^{ + 1} \mathop {{H_2}}\limits^0 \]
3) \[2\mathop {KCl}\limits^{ + 5} \mathop {{O_3}}\limits^{ - 2} \to 2\mathop {KCl + }\limits^1 \mathop {3{O_2}}\limits^0 \]
Đáp án cần chọn là: D
Câu 4:
Trong các phản ứng dưới đây, phản ứng nào không phải là phản ứng oxi hoá - khử?
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng không phải là phản ứng oxi hoá - khử là phản ứng không làm thay đổi số oxi hóa các chất
FeS + 2HCl → FeCl2 + H2S
Đáp án cần chọn là: B
Câu 5:
Ở phản ứng nào sau đây, H2O không đóng vai trò chất oxi hoá hay chất khử?
 Xem đáp án
Xem đáp án
Trả lời:
H2O không đóng vai trò chất oxi hoá hay chất khử =>H2O không thay đổi số oxi hóa
\[A{l_4}{C_3} + 12\mathop {{H_2}}\limits^{ + 1} \mathop O\limits^{ - 2} \to 4\mathop {Al{{\left( {O\mathop H\limits^{ + 1} } \right)}_3} + }\limits^{ - 2} 3C\mathop {{H_4}}\limits^{ + 1} \]
Đáp án cần chọn là: D
Câu 6:
Cho quá trình sau: \[\mathop {Fe}\limits^{ + 3} + 1e \to \mathop {Fe}\limits^{ + 2} \]. Trong các kết luận sau, kết luận nào là đúng?
 Xem đáp án
Xem đáp án
Trả lời:
Quá trình nhận electron gọi là quá trình khử (sự khử)
Đáp án cần chọn là: B
Câu 7:
Phản ứng oxi hoá - khử nào sau đây chỉ có sự thay đổi số oxi hoá của một nguyên tố?
 Xem đáp án
Xem đáp án
Trả lời:
\[A.2K\mathop {Cl}\limits^{ + 5} \mathop {{O_3}}\limits^{ - 2} \mathop \to \limits^{t^\circ } 2K\mathop {Cl}\limits^{ - 1} + 3\mathop {{O_2}}\limits^0 \]
Có sự thay đổi số oxi hóa của Clo và oxi
\[B.2K\mathop {Mn}\limits^{ + 7} \mathop {{O_4}}\limits^{ - 2} \mathop \to \limits^{t^\circ } {K_2}Mn{O_4} + \mathop {Mn{O_2}}\limits^{ + 4} + \mathop {{O_2}}\limits^0 \]
Có sự thay đổi số oxi hóa của Mn và O
\[C.2K\mathop N\limits^{ + 5} \mathop {{O_3}}\limits^{ - 2} \mathop \to \limits^{t^\circ } 2K\mathop N\limits^{ + 3} {O_2} + \mathop {{O_2}}\limits^0 \]
Có sự thay đổi số oxi hóa của N và O
\[D.\mathop {N{H_4}}\limits^{ - 3} \mathop {N{O_3}}\limits^{ + 5} \mathop \to \limits^{t^\circ } \mathop {{N_2}O}\limits^{ + 1} + 2{H_2}O\]
Chỉ có sự thay đổi số oxi hóa của N
Đáp án cần chọn là: D
Câu 8:
Trong các phản ứng sau, phản ứng nào HCl đóng vai trò là chất oxi hoá?
 Xem đáp án
Xem đáp án
Trả lời:
Đóng vai trò là chất oxi hóa ⇒ giảm số oxi hóa
- Phản ứng A và D: \[\mathop {2Cl}\limits^{ - 1} \to C{l_2} + e\]
Số oxi hóa của Clo tăng =>HCl là chất khử và là chất tạo môi trường
- Phản ứng B không làm thay đổi số oxi hóa của HCl
- Phản ứng C:
\[\mathop {2H}\limits^{ + 1} + 2e \to {H_2}\]
⇒ H từ +1 → 0 số oxi hóa giảm =>HCl là chất oxi hóa
Đáp án cần chọn là: C
Câu 9:
Trong các phản ứng hóa học, SO2 có thể là chất oxi hoá hoặc chất khử vì
 Xem đáp án
Xem đáp án
Trả lời:
SO2 có thể là chất oxi hoá hoặc chất khử vì lưu huỳnh trong SO2 có số oxi hóa trung gian.
Đáp án cần chọn là: C
Câu 10:
Cho các chất và ion sau: Zn, S, FeO, ZnO, SO2, Fe2+, Cu2+, HCl. Tổng số phân tử và ion trong dãy vừa có tính oxi hóa, vừa có tính khử là
 Xem đáp án
Xem đáp án
Trả lời:
Có 5 chất và ion vừa có tính oxi hóa và tính khử là: S, FeO, SO2, Fe2+, HCl
Đáp án cần chọn là: A
Câu 11:
Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hoá và môi trường trong phản ứng : FeO + HNO3 → Fe(NO3)3 + NO + H2O là bao nhiêu?
 Xem đáp án
Xem đáp án
Trả lời:
\[\mathop {Fe}\limits^{ + 2} O + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 3} {\left( {N{O_3}} \right)_3} + \mathop N\limits^0 O + {H_2}O\]
\[{}_{1x}^{3x}\left| {\begin{array}{*{20}{c}}{\mathop {Fe}\limits^{ + 2} \to \mathop {Fe}\limits^{ + 3} + 1e}\\{\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} }\end{array}} \right.\]
=>cân bằng: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
=>Tỉ lệ số phân tử HNO3 đóng vai trò là chất oxi hoá và môi trường là 1 : 9
Đáp án cần chọn là: C
Câu 12:
Hệ số của HNO3 trong phản ứng: Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O (biết tỉ lệ mol của N2O : N2 = 2 : 3) là
 Xem đáp án
Xem đáp án
Trả lời:
\[\mathop {Zn}\limits^{ + 2} + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Zn}\limits^{ + 2} {\left( {N{O_3}} \right)_2} + \mathop {{N_2}}\limits^{ + 1} O + \mathop {{N_2}}\limits^0 + {H_2}O\]
\[{}_{1x}^{23x}\left| {\begin{array}{*{20}{c}}{\mathop {Zn}\limits^0 \to \mathop {Zn}\limits^{ + 2} + 2e}\\{10\mathop N\limits^{ + 5} + 46e \to 2\mathop {{N_2}O + 3\mathop {{N_2}}\limits^0 }\limits^{ + 2} }\end{array}} \right.\]
+) Vì tỉ lệ mol của N2O : N2 là 2 : 3
=>thêm 2 trước N2O và thêm 3 trước N2 sau đó tính tổng e nhận = 10.5 - 2.2.1 - 0 = 46
+) Chọn hệ số sao cho tổng e cho = tổng e nhận
=>nhân 23 ở quá trình cho e và nhân 1 ở quá trình nhận e
=>cân bằng: 23Zn + 56HNO3 → 23Zn(NO3)2 + 2N2O + 3N2 + 28H2O
Đáp án cần chọn là: B
Câu 13:
Phản ứng nào sau đây thuộc loại phản ứng tự oxi hoá, tự khử (hay tự oxi hoá - khử)?
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng thuộc loại phản ứng tự oxi hoá, tự khử là chất khử đồng thời cũng là chất oxi hóa (thuộc cùng 1 nguyên tố)
=>Cl2 + 2KOH → KClO + KCl + H2O
Đáp án cần chọn là: D
Câu 14:
Cho các phản ứng oxi hoá − khử sau:
2H2O2 → 2H2O + O2 (1)
2HgO → 2Hg + O2 (2)
Cl2 + 2KOH → KCl + KClO + H2O (3)
2KClO3 → 2KCl + 3O2 (4)
3NO2 + H2O → 2HNO3 + NO (5)
2KMnO4 → K2MnO4 + MnO2 + O2 (6)
Trong số các phản ứng trên, có bao nhiêu phản ứng oxi hoá − khử nội phân tử?
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng oxi hóa – khử nội phân tử: chất khử và chất oxi hóa thuộc cùng 1 phân tử nhưng ở 2 nguyên tử khác nhau
=>những phản ứng là:
2HgO → 2Hg + O2 (2)
2KClO3 → 2KCl + 3O2 (4)
2KMnO4 → K2MnO4 + MnO2 + O2 (6)
Đáp án cần chọn là: B
Câu 15:
Trong các loại phản ứng dưới đây, loại phản ứng nào luôn là phản ứng oxi hoá − khử?
 Xem đáp án
Xem đáp án
Trả lời:
Loại phản ứng luôn là oxi hoá − khử là phản ứng thế
Đáp án cần chọn là: D
Câu 16:
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng dư thu được dung dịch X. Dung dịch tác dụng được với chất nào sau đây không xảy ra phản ứng oxi hóa khử:
 Xem đáp án
Xem đáp án
Trả lời:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
Dung dịch X gồm Fe2+, Fe3+, H+, SO42-.
Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của các nguyên tố.
Khi NaOH phản ứng với Fe2+, Fe3+ và H+ đều là phản ứng trao đổi (không có sự thay đổi số oxi hóa của các nguyên tố)
Đáp án cần chọn là: B
Câu 17:
Dấu hiệu để nhận biết một phản ứng oxi hóa khử:
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố
Đáp án cần chọn là: D
Câu 18:
Quá trình nào sau đây là đúng
 Xem đáp án
Xem đáp án
Trả lời:
Quá trình đúng là: \[\mathop S\limits^{ - 2} \to \mathop S\limits^0 + 2e\]
Đáp án cần chọn là: C
Câu 19:
Cho phản ứng: Mg + H2SO4 → MgSO4 + S + H2O. Tổng hệ số cân bằng là:
 Xem đáp án
Xem đáp án
Trả lời:
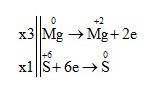
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
Tổng hệ số cân bằng là: 3 + 4 + 3 + 1 + 4 = 15
Đáp án cần chọn là: D
Câu 20:
Cho sơ đồ phản ứng : Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Sau khi cân bằng, hệ số của phân tử các chất là phương án nào sau đây?
 Xem đáp án
Xem đáp án
Trả lời:
\[{\mathop {Fe}\limits^{ + 8/3} _3}{O_4} + H\mathop N\limits^{ + 5} {O_3} \to \mathop {Fe}\limits^{ + 2} {\left( {N{O_3}} \right)_3} + \mathop N\limits^{ + 2} O + {H_2}O\]
\[{}_{1x}^{3x}\left| {\begin{array}{*{20}{c}}{\mathop {3Fe}\limits^{ + 8/3} \to \mathop {3Fe}\limits^{ + 3} + 1e}\\{\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} }\end{array}} \right.\]
=>cân bằng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
=>hệ số cân bằng là: 3, 28, 9, 1, 14
Đáp án cần chọn là: B
