30 Bài tập Tốc độ phản ứng hóa học có lời giải chi tiết
-
2525 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Phát biểu nào sau đây đúng ?
 Xem đáp án
Xem đáp án
Đáp án B
là độ biến thiên của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Câu 3:
Trong các cặp phản ứng sau, phản ứng nào có tốc độ lớn nhất ?
 Xem đáp án
Xem đáp án
Đáp án D
Nồng độ HCl lớn hơn sẽ có tốc độ phản ứng lớn hơn
Câu 4:
Cho phản ứng hóa học: A(k) + 2B(k) + nhiệt → AB2(k). Tốc độ phản ứng sẽ tăng, nếu
 Xem đáp án
Xem đáp án
Đáp án A
Vì 2 chất tham gia phản ứng là chất khí nên nếu tăng áp suất thì tốc độ phản ứng sẽ tăng
Câu 5:
Tăng diện tích bề mặt của chất phản ứng trong một hệ dị thể, kết quả sẽ là :
 Xem đáp án
Xem đáp án
Đáp án B
tăng diện tích bề mặt của chất phản ứng sẽ làm tăng số lần va chạm hiệu quả giữa các phân tử do đó làm tăng tốc độ phản ứng.
Câu 6:
Cho phản ứng: Zn(r) + 2HCl(dd) → ZnCl2(dd) + H2(k)
Nếu tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ:
 Xem đáp án
Xem đáp án
Đáp án C
Tăng nồng độ HCl lên thì số phân tử HCl sẽ tăng, do đó số lần va chạm hiệu quả giữa phân tử Zn và HCl sẽ tăng lên, do đó tốc độ phản ứng tăng
Câu 7:
Khi cho cùng một lượng dung dịch axit sunfuric vào hai cốc đựng cùng một thể tích dung dịch Na2S2O3 với nồng độ khác nhau, ở cốc đựng dung dịch Na2S2O3 có nồng độ lớn hơn thấy xuất hiện kết tủa trước. Điều đó chứng tỏ, ở cùng điều kiện nhiệt độ, tốc độ phản ứng:
 Xem đáp án
Xem đáp án
Đáp án B
Tốc độ phản ứng tỷ lệ thuận với nồng độ của chất phản ứng:
Câu 8:
Cho kẽm hạt tác dụng với dung dịch H2SO4 4M ở nhiệt độ thường. Tác động nào sau đây không làm tăng vận tốc của phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án D
Tăng thể tích dung dịch H2SO4 lên gấp đôi nhưng nồng độ vẫn không đổi nên không làm tăng tốc độ phản ứng
Câu 9:
Khi cho axit clohiđric tác dụng với Kali pemanganat (rắn) để điều chế khí clo, để khí clo thoát ra nhanh hơn, ta phải:
 Xem đáp án
Xem đáp án
Đáp án A
Để khí clo thoát ra nhanh hơn thì dùng HCl đặc ( nồng độ cao) và đun nhẹ hỗn hợp (tăng nhiệt độ phản ứng)
Câu 10:
Trong quá trình nung vôi, người ta phải đập nhỏ đá vôi ở kích thước vừa phải. Yếu tố nào đã được vận dụng để làm tăng tốc độ phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án C
Đập nhỏ đá vôi ở kích thước vừa phải nhằm tăng diện tích tiếp xúc,làm các phân tử dễ va chạm với nhau hơn, do đó làm tăng tốc độ phản ứng
Câu 11:
Câu nào sau đây đúng ?
 Xem đáp án
Xem đáp án
Đáp án D
Có nhiều yếu tốc ảnh hưởng đến tốc độ phản ứng, tùy theo phản ứng mà có thể vận dụng một hoặc nhiều nhiều tố ảnh hưởng đến tốc độ phản ứng để điều chỉnh tốc độ phản ứng
Câu 12:
Khi tăng nhiệt độ, tốc độ phản ứng tăng là do:
 Xem đáp án
Xem đáp án
Đáp án A
Để khí clo thoát ra nhanh hơn thì dùng HCl đặc ( nồng độ cao) và đun nhẹ hỗn hợp (tăng nhiệt độ phản ứng)
Câu 13:
Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng sau:
2KClO3 (r)–––to–→ 2KCl (r) + 3O2 (k)
 Xem đáp án
Xem đáp án
Đáp án C
Vì chất tham gia phản ứng là chất rắn nên áp suất sẽ không ảnh hưởng đến tốc độ phản ứng trên.
Câu 14:
Cho 5 gam Al viên vào cốc đựng 50 ml dung dịch HCl 2M ở nhiệt độ thường. Trường hợp nào sau đây, tốc độ phản ứng không thay đổi ?
 Xem đáp án
Xem đáp án
Đáp án D
Đáp án D, tốc độ phản ứng không thay đổi vì khi tăng thể tích HCl lên gấp đôi thì nồng độ HCl vẫn không đổi nên không ảnh hưởng đến tốc độ phản ứng
Câu 15:
Trong quá trình sản xuất gang, xảy ra phản ứng :
Fe2O3 (r) + 3CO (k) 2Fe (r) + 3CO2 (k) ; ∆H > 0. Có thể dùng biện pháp nào dưới đây để tăng tốc độ phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án A
Các yếu tố ảnh hưởng đến tốc độ phản ứng gồm
+ Nhiệt độ : tăng nhiệt độ tốc độ phản ứng tăng → A đúng
+ Nồng độ : tăng nồng độ của chất phản ứng thì tốc độ phản ứng tăng. Chú ý khi nén để làm tăng nồng độ CO2 là sản phẩm phản ứng → C sai
+ Diện tích tiếp xúc: tăng diện tích tiếp xúc của chất phản ứng thì tốc độ phản ứng tăng. Tăng kích thước của quặng làm giảm diện tích tiếp xúc → B sai
+ Áp suât. Với phản ứng có sự tham gia của chất khí, tăng áp suất thì tốc độ phản ứng tăng → D sai
+ Xúc tác
Câu 16:
Kẽm đang phản ứng mạnh với axit clohiđric, nếu cho thêm muối natri axetat vào dung dịch thì thấy phản ứng
 Xem đáp án
Xem đáp án
Đáp án D
Khi thêm muối natri axetat vào dung dịch thì muối có phản ứng với HCl, nên nồng độ HCl giảm -> Tốc độ phản ứng của kẽm với HCl giảm
Các yếu tố ảnh hưởng đến tốc độ phản ứng là nồng độ, nhiệt độ, áp suất, diện tích tiếp xúc, chất xúc tác
Câu 17:
Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohiđric:
- Nhóm 1: Cân miếng kẽm 1g và thả vào cốc đựng 200ml dung dịch axit HCl 2M.
- Nhóm 2: Cân 1g bột kẽm và thả vào cốc đựng 300ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thóat ra ở thí nghiệm của nhóm 2 mạnh hơn là do:
 Xem đáp án
Xem đáp án
Đáp án A
Các yếu tố ảnh hưởng đến tốc độ phản ứng là: nồng độ (càng cao tốc độ càng tăng), nhiệt độ (càng cao tốc độ càng tăng), diện tích tiếp xúc (càng cao tốc độ càng tăng), áp suất (với chất khí càng cao tốc độ càng tăng), xúc tác (luôn tăng)
Ta thấy ở thí nghiệm 2 nồng độ HCl, nhiệt độ, áp suất, xt là như nhau. Diện tích tx ở nhóm 2 nhiều hơn nhóm 1 (do bột nhỏ hơn miếng) nên nhóm 2 khí thoát ra mạnh hơn
Câu 18:
Có 3 cốc chứa 20ml dung dịch H2O2 cùng nồng độ. Tiến hành 3 thí nghiệm như hình vẽ sau:
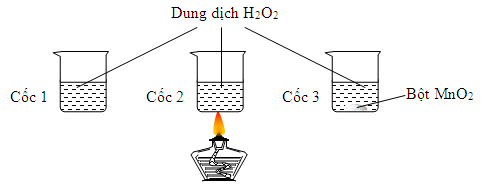
TN1: Ở nhiệt độ thường TN2: Đun nóng TN3: Thêm ít bột MnO2
Ở thí nghiệm nào có bọt khí thoát ra chậm nhất?
 Xem đáp án
Xem đáp án
Đáp án A
Khi tăng nồng độ chất phản ứng và khi có sự có mặt của chất xúc tác thì tốc độ phản ứng tăng.
→ Cốc 1 bọt khí xuất hiện chậm nhất.
→ Chọn A
Câu 19:
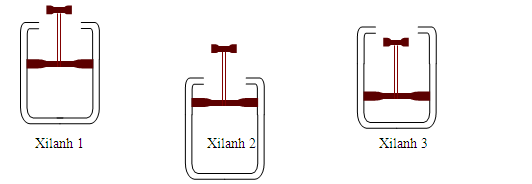
Có 3 xilanh kín, nạp vào mỗi xilanh cùng 1 lượng NO2, giữ cho 3 xilanh cùng ở nhiệt độ phòng và di chuyển pittông của 3 xilanh như hình vẽ. Hỏi ở xilanh nào hỗn hợp khí có màu đậm nhất?
 Xem đáp án
Xem đáp án
Đáp án A
N2O4 (không màu, k) <=> 2NO2 (màu nâu đỏ, k)
Hình 2 biểu thị việc kéo xi lanh lên nghĩa là làm giảm áp suất của hệ → cân bằng chuyển dịch theo chiều làm tăng số mol khí → màu đậm lên.
Hình e biểu thị việc nén xi lanh xuống nghĩa là làm tăng áp suất của hệ → cân bằng chuyển dịch theo chiều làm giảm số mol khí → màu nhạt đi.
Câu 20:
Cho cân bằng sau:
CuO(r) + CO(k) → Cu(r) + CO2(k)
Đồ thị nào sau đây biểu diễn đúng sự phụ thuộc tốc độ phản ứng vào áp suất:
 Xem đáp án
Xem đáp án
Đáp án C
Chú ý câu hỏi sự phụ thuộc của tốc độ phản ứng vào áp suất. Khi áp suất tăng thì tốc độ phản ứng tăng.
Câu 21:
Tốc độ phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án C
Tốc độ phản ứng là biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Tốc độ tính theo chất sản phẩm bằng tốc độ tính theo chất phản ứng
Câu 22:
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án A
Không khí trước khi thổi vào lò luyện gang được nén lại để làm tăng áp suất, và được thổi qua bề mặt nóng của than cốc
Vậy các yếu tố ảnh hưởng đến tốc độ phản ứng là nhiệt độ, áp suất. Đáp án A
Câu 23:
Có phương trình phản ứng: 2A + B → C. Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức v=k[A]2.[B]. Hằng số tốc độ k phụ thuộc:
 Xem đáp án
Xem đáp án
Đáp án C
Hằng số tốc độ k chỉ phụ thuộc vào bản chất của phản ứng và nhiệt độ của phản ứng
Câu 24:
Khi ninh (hầm) thịt cá, người ta làm gì cho chúng nhanh chín ?
 Xem đáp án
Xem đáp án
Đáp án D
Khi ninh (hầm) thịt cá, người ta làm gì cho chúng nhanh chín hơn người ta dùng
+ nồi áp suất để tăng áp suất → tốc độ phân hủy xảy ra nhanh hơn
+ chặt nhỏ thịt cá → tăng diện tích tiếp xúc → tăng tốc độ phản ứng phân hủy
+ cho thêm muối làm tăng nồng độ chất phản ứng,→ làm gia vị, tăng tốc độ phản ứng
Câu 25:
Tăng nhiệt độ của một hệ phản ứng sẽ dẫn đến sự va chạm có hiệu quả giữa các phân tử chất phản ứng. Tính chất của sự va chạm đó là:
 Xem đáp án
Xem đáp án
Đáp án A
Khi tăng nhiệt độ của một hệ phản ứng sẽ dẫn đến sự va chạm có hiệu quả giữa các phân tử chất phản ứng là tăng tốc
độ phản ứng, nhưng khi đến một lúc nào đó, thì sự chạm có hiệu quả đó sẽ giảm dần do các chất đã kết hợp với nhau thành sản phẩm
Câu 26:
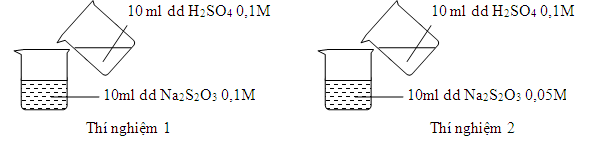
Thực hiện 2 thí nghiệm theo hình vẽ sau. Ở thí nghiệm nào có kết tủa xuất hiện trước?
 Xem đáp án
Xem đáp án
Đáp án A
Ta thấy tốc độ phản ứng phụ thuộc vào nồng độ, nhiệt độ, diện tích tiếp xúc, áp suất và chất xúc tác.
Ở đây cả 2 phản ứng có cùng lượng axit, vì vậy dung dịch Na2S2O3 nào có nồng độ lớn hơn thì kết tủa xuất hiện trước -> TN1
Câu 27:
Trong phản ứng tổng hợp amoniac : H2 + 3N2 ⇄ 2NH3. Yếu tố không làm tăng tốc độ phản ứng là
 Xem đáp án
Xem đáp án
Đáp án D
+ tăng nhiệt độ thì tốc độ phản ứng tăng
+ nén hỗn hợp khí trước khi đưa vào tháp tổng hợp làm tăng áp suất phản ứng → tốc độ phản ứng tăng
+ thêm chất xúc tác tốc độ phản ứng tăng.
Khi giảm nhiệt độ thì tốc độ phản ứng giảm. Đáp án D.
Câu 28:
Trong các thí nghiệm sau, nếu lượng Fe trong các cặp đều được lấy bằng nhau thì ở thí nghiệm nào tốc độ phản ứng là lớn nhất ?
 Xem đáp án
Xem đáp án
Đáp án D
D: Giả sử
=> = 1000V . 1,2 = 1200v =>1200 . 0,2 = 240V
6,57 => [HCl] = 6,57 (M)
Vì nồng độ ở D lớn hơn nên sẽ có tốc độ phản ứng lớn nhất
Câu 29:
Cho 5 gam kẽm viên vào cốc đựng 50ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC). Có các tác động sau:
(a) Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
(b) Thêm 50 ml dung dịch H2SO4 4M nữa.
(c) Thay 50 ml dung dịch H2SO4 4M bằng 100ml dung dịch H2SO4 2M.
(d) Đun nóng dung dịch.
Số trường hợp tốc độ phản ứng không đổi là
 Xem đáp án
Xem đáp án
Đáp án B
A, Kẽm bột sẽ tiếp xúc với H2SO4 nhiều hơn nên tốc độ phản ứng nhanh hơn
B, Thêm 50 ml H2SO4 nhưng với nồng độ không đổi thì không làm thay đổi tốc độ phản ứng
C, thay bằng H2SO4 có nồng độ thấp hơn thì phản ứng sẽ xảy ra chậm hơn
D, đun nóng dung dịch làm tốc độ phản ứng nhanh hơn
Câu 30:
Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 450C :
N2O5 → N2O4 + ![]() O2
O2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình của phản ứng tính theo N2O5 là
 Xem đáp án
Xem đáp án
Đáp án A
Tốc độ trung bình của phản ứng tính theo N2O5 là
v= ∆C/ ∆t = = 1,36. 10-3 mol/(l.s)
Đáp án A
