Trắc nghiệm Bài 14: Ôn tập chương 3 có đáp án
-
519 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
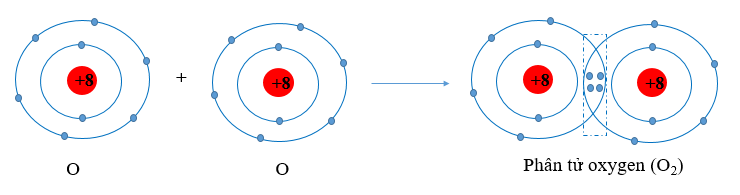
Khi hình thành liên kết hóa học trong phân tử O2, nguyên tử oxygen góp chung bao nhiêu electron theo quy tắc octet?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi hình thành liên kết hóa học trong phân tử O2, nguyên tử oxygen có 6 electron hóa trị, mỗi nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử oxygen góp chung 2 electron.
Câu 2:
Anion X- có cấu hình electron là 1s22s22p63s23p6. Cấu hình electron của nguyên tử X là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Anion X- có cấu hình electron là 1s22s22p63s23p6.
Nguyên tử X nhận 1 electron để tạo thành anion X- nên cấu hình electron của nguyên tử X là 1s22s22p63s23p5.
Câu 3:
Cation Y2+ có cấu hình electron là 1s22s22p63s23p63d9. Cấu hình electron của nguyên tử Y là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cation Y2+ có cấu hình electron là 1s22s22p63s23p63d9.
Nguyên tử Y nhường 2 electron để tạo thành cation Y2+ nên cấu hình electron của nguyên tử Y là 1s22s22p63s23p63d104s1.
Câu 4:
Yếu tố nào làm nên tính chất đặc trưng của tinh thể ion?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lực hút tĩnh điện của các ion mang điện tích trái dấu làm nên tính chất đặc trưng của tinh thể ion. Các hợp chất ion thường là chất rắn có nhiệt độ nóng chảy và nhiệt độ sôi cao, có khả năng dẫn điện khi tan trong nước hay khi nóng chảy.
Câu 5:
Liên kết cộng hóa trị được tạo thành bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử phi kim có lớp electron hóa trị gần bão hòa và có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của nguyên tử khí hiếm. Khi hai nguyên tử phi kim kết hợp với nhau tạo thành phân tử chúng sẽ góp một hoặc nhiều electron để tạo thành các cặp electron dùng chung. Các cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử.
Câu 6:
Đa số các hợp chất cộng hóa trị có đặc điểm là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các chất có liên kết cộng hóa trị phân cực tan nhiều trong nước, còn các chất có liên kết cộng hóa trị không phân cực thì ít tan trong nước.
Hợp chất cộng hóa trị không có lực hút tĩnh điện mạnh như hợp chất ion nên chúng có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu 7:
Phân tử chất nào sau đây chỉ có các liên kết cộng hóa trị phân cực?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phân tử H2O chỉ có các liên kết cộng hóa trị phân cực do hiệu độ âm điện là 3,44 -2,2 = 1,24 (0,4 ≤ < 1,7).
Câu 8:
Liên kết cho – nhận có những tính chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết cho – nhận bền tương đương với liên kết cộng hóa trị, không bền bằng liên kết ion và bền hơn liên kết hydrogen.
Câu 9:
Liên kết hóa học trong phân tử HCl là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Liên kết hóa học trong phân tử HCl là liên kết cộng hóa trị phân cực do hiệu độ âm điện là 3,16 -2,2 = 0,96 (0,4 ≤ < 1,7).
Câu 10:
Cho biết độ âm điện của O là 3,44 và của S là 2,58. Liên kết hình thành trong phân tử SO2 là liên kết:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Liên kết hóa học trong phân tử SO2 là liên kết cộng hóa trị phân cực do hiệu độ âm điện là 3,44 -2,58 = 0,86 (0,4 ≤ < 1,7).
Câu 11:
Dãy nào sau đây gồm các chất đều có liên kết π trong phân tử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức cấu tạo của các chất: C3H6 (H2C=CH‒CH3), C2H2 (HC≡CH), O2 (O=O), N2 (N≡N).
Câu 12:
Dãy nào sau đây gồm các chất mà phân tử đều không bị phân cực?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các chất mà phân tử đều không bị phân cực là: Cl2, CO2, C2H2.
Chú ý: Trong phân tử CO2, liên kết giữa C và O phân cực nhưng phân tử CO2 có cấu tạo thẳng nên cả phân tử không phân cực.
Câu 13:
Số liên kết π và liên kết σ trong phân tử C3H6 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Công thức cấu tạo C3H6 (H2C=CH‒CH3)
=> Phân tử C3H6 có 1 liên kết π và 8 liên kết σ.
Câu 14:
Nguyên nhân nào làm cho các cặp electron dùng chung bị hút lệch về phía của nguyên tử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Sự chênh lệch độ âm điện lớn làm cho các liên kết phân cực, cặp electron dùng chung trong liên kết cộng hóa trị bị hút lệch về phía các nguyên tử có độ âm điện lớn hơn.
Câu 15:
Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia vào liên kết.
