Trắc nghiệm Hóa 10 Dạng 1. Câu hỏi lí thuyết Tốc độ phản ứng hóa học có đáp án
-
936 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hoàn toàn có thể dựa vào sự thay đổi của đại lượng nào trong một đơn vị thời gian để đánh giá mức độ nhanh, chậm của phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Hoàn toàn có thể dựa vào sự thay đổi nồng độ của chất phản ứng (hoặc chất sản phẩm) trong một đơn vị thời gian để đánh giá mức độ nhanh, chậm của phản ứng.
Câu 2:
Tốc độ phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Câu 3:
Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các yếu tố ảnh hưởng đến tốc độ phản ứng là: nồng độ, áp suất, diện tích bề mặt, nhiệt độ, chất xúc tác.
Vậy khối lượng chất rắn không ảnh hưởng đến tốc độ phản ứng.
Câu 4:
Chất xúc tác là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả lượng và chất sau khi phản ứng kết thúc.
Câu 5:
Yếu tố nào sau đây luôn làm tăng tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tăng diện tích tiếp xúc giữa các chất phản ứng làm tăng tốc độ phản ứng.
Câu 6:
Thông thường đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thông thường đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng.
Câu 7:
Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tốc độ phản ứng cho biết mức độ nhanh chậm của một phản ứng hóa học.
Câu 8:
Thực hiện 2 thí nghiệm theo hình vẽ sau.
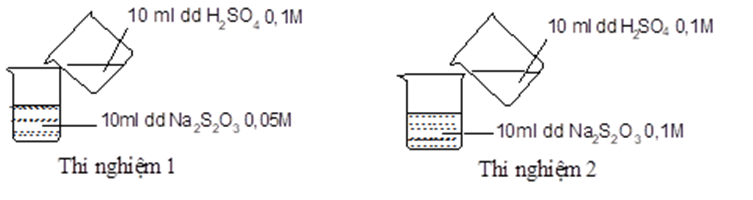
Ở thí nghiệm nào xuất hiện kết tủa trước?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ở thí nghiệm 2 có kết tủa xuất hiện trước do nồng độ Na2S2O3 ở thí nghiệm 2 lớn hơn so với ở thí nghiệm 1.
Câu 9:
Cho cùng một lượng kẽm (zinc) vào các cốc khác nhau chứa cùng một lượng dung dịch hydrochloric acid, trường hợp nào sẽ có tốc độ phản ứng nhanh nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cùng một lượng kẽm thì kẽm ở dạng bột mịn có diện tích bề mặt lớn nhất.
Vậy tốc độ phản ứng diễn ra nhanh nhất khi sử dụng kẽm ở dạng bột mịn và khuấy nhẹ.
Câu 10:
Cho các phản ứng sau:
(1) Phản ứng than cháy trong không khí.
(2) Phản ứng tạo gỉ sắt.
(3) Phản ứng nổ của khí bình gas.
(4) Phản ứng lên men rượu.
Phản ứng xảy ra với tốc độ nhanh nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phản ứng xảy ra với tốc độ nhanh nhất là:
(3) Phản ứng nổ của khí bình gas.
Câu 11:
Chọn đáp án đúng nhất. Tốc độ tức thời của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
Câu 12:
Khi nồng độ chất tham gia phản ứng càng lớn thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khi nồng độ chất tham gia phản ứng càng lớn thì tốc độ phản ứng càng lớn.
Câu 13:
Để hạn chế sự ôi thiu thực phẩm do các phản ứng của oxygen cũng như sự hoạt động của vi khuẩn, người ta thường bơm khí nào sau đây vào các túi đựng thực phẩm trước khi đóng gói?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Thực phẩm bị ôi thiu do các phản ứng oxi hóa của oxygen cũng như hoạt động của vi khuẩn. Để hạn chế sự ôi thiu, người ta bơm khí N2 hoặc CO2 vào túi đựng thực phẩm trước khi đóng gói. Khi đó nồng độ khí oxygen sau khi bơm N2 hoặc CO2 chỉ còn 2 – 5%.
Câu 14:
Tốc độ phản ứng tính theo định luật tác dụng khối lượng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng tính theo định luật tác dụng khối lượng là tốc độ tức thời của phản ứng tại một thời điểm.
Câu 15:
Nhận xét nào sau đây là không đúng về hằng số tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu D sai vì: Hằng số tốc độ của phản ứng càng lớn thì tốc độ của phản ứng đó càng lớn.
Câu 16:
Phản ứng của H2 và I2 là phản ứng đơn giản:
H2 (g) + I2 (g) → 2HI (g)
Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Theo định luật tác dụng khối lượng, tốc độ của phản ứng được viết dưới dạng là:
\[v = k{C_{{H_2}}}{C_{{I_2}}}.\]
Câu 17:
Nếu chia một vật thành nhiều phẩn nhỏ hơn thì tổng diện tích bề mặt sẽ
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nếu chia một vật thành nhiều phẩn nhỏ hơn thì tổng diện tích bề mặt sẽ tăng lên.
Câu 18:
Hệ số nhiệt độ Van’t Hoff được kí hiệu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hệ số nhiệt độ Van’t Hoff được kí hiệu là γ.
Câu 19:
Chất làm giảm tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chất làm giảm tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là chất ức chế.
Câu 20:
Biện pháp nào sau đây không làm tăng diện tích bề mặt của khối chất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nếu kích thước hạt càng nhỏ thì tổng diện tích bề mặt càng lớn, nên có thể tăng diện tích tiếp xúc bằng cách đập nhỏ hạt.
Ngoài ra, tạo nhiều đường rãnh, lỗ xốp trong lòng khối chất cũng làm tăng diện tích bề mặt khối chất.
Vậy làm đầy các rãnh trên bề mặt khối chất không làm tăng diện tích bề mặt của khối chất.
Câu 21:
Năng lượng hoạt hóa là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Năng lượng hoạt hóa là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
Câu 22:
Nhận xét nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nhận xét B sai vì: Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
Câu 23:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng chỉ nhận giá trị dương, do đó phải thêm dấu trừ trong biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
Câu 24:
Cho phản ứng đơn giản xảy ra trong bình kín:
3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 không đổi và nồng độ N2 tăng 2 lần?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo định luật tác dụng khối lượng: \(v = kC_{{H_2}}^3C_{{N_2}}^{}\)
Nếu nồng độ H2 không đổi và nồng độ N2 tăng lên 2 lần, ta có:
\[v' = k\left( {C_{{H_2}}^3} \right)\left( {2.C_{{N_2}}^{}} \right) = 2 \cdot kC_{{H_2}}^3C_{{N_2}}^{} = 2v.\]
Vậy tốc độ phản ứng tăng 2 lần.
Câu 25:
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Áp dụng công thức:
\( \Rightarrow {v_2} = {v_1} \times {2^{\frac{{40 - 70}}{{10}}}} = {2^{ - 3}}{v_1} = \frac{1}{8}{v_1}\)
Như vậy khi nhiệt độ giảm từ 70oC xuống 40oC thì tốc độ phản ứng giảm 8 lần.
Câu 26:
Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các phản ứng khác nhau có tốc độ phản ứng khác nhau, không thể xác định được một cách tổng quát khoảng thời điểm mà tại đó tốc độ phản ứng hóa học là lớn nhất.
Câu 27:
Biểu đồ nào sau đây không biểu diễn sự phụ thuộc nồng độ chất tham gia với thời gian?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Biểu đồ C cho thấy nồng độ tăng dần theo thời gian, do đó biểu đồ này không biểu diễn sự phụ thuộc nồng độ chất tham gia với thời gian.
Câu 28:
Cho phương trình phản ứng tổng quát sau:
2A + B → C
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức:
\[v = kC_A^2{C_B}\]
Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây? Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hằng số k đặc trưng cho mỗi phản ứng và chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
Câu 29:
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các biện pháp giúp rút ngắn thời gian tiến hành thí nghiệm: (1); (2); (4).
Câu 30:
Hình ảnh dưới đây minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng:
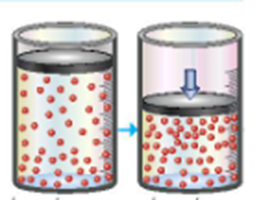
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên hay áp suất tăng lên.
