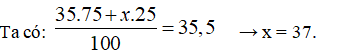Đề thi học kì 1 Hóa học 10 (Đề 1)
-
3482 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Phần trắc nghiệm
Kí hiệu nào trong số các kí hiệu sau là sai?
 Xem đáp án
Xem đáp án
Chọn B
Không có phân lớp 2d.
Câu 2:
Số hạt p, n, e trong ion lần lượt là:
 Xem đáp án
Xem đáp án
Chọn C
Số hạt p = z = 20
Số hạt n = A – z = 40 – 20 = 20.
Số hạt e = 20 – 2 = 18
Câu 3:
Cho 3 nguyên tố X (Z = 14), Y (Z = 17), Z (Z = 15). Dãy các nguyên tố có bán kính nguyên tử tăng dần là:
 Xem đáp án
Xem đáp án
Chọn D
Ta có X, Y, Z thuộc cùng chu kỳ,
→ Bán kính nguyên tử: Y < Z < X.
Câu 4:
Nguyên tử của nguyên tố X có tổng số hạt là 40. Trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là:
 Xem đáp án
Xem đáp án
Chọn A
Gọi số hạt proton, nơtron, electron trong X lần lượt là p, n và e (trong đó p = e)
Theo bài ra có: 2p + n = 40 và 2p – n = 12.
Giải hệ phương trình được p = 13 và n = 14.
Số khối A = 13 + 14 = 27.
Câu 6:
Nguyên tố X có hai đồng vị, đồng vị thứ nhất chiếm 75%. Nguyên tử khối trung bình của X là 35,5. Đồng vị thứ hai là:
 Xem đáp án
Xem đáp án
Chọn C
Gọi nguyên tử khối trung bình của đồng vị thứ 2 là x
Câu 8:
Cho các nguyên tố sau: X (Z = 12); Y (Z = 34); G (Z = 22); H (Z = 29). Xác định vị trí của 2 nguyên tố X, G trong bảng tuần hoàn. Giải thích?
 Xem đáp án
Xem đáp án
Vị trí của X, G trong bảng tuần hoàn. (1,0 điểm)
X: - Ô: 12 (vì Z = 12)
- Chu kì: 3 (vì có 3 lớp e)
- Nhóm: IIA (vì là nguyên tố s và có 2 electron lớp ngoài cùng)
G: - Ô: 22 (vì Z = 22)
- Chu kì: 4 (vì có 4 lớp e)
- Nhóm: IVB (vì là nguyên tố d và có 4 electron hoá trị)
Câu 9:
Cho các nguyên tố sau: X (Z = 12); Y (Z = 34); G (Z = 22); H (Z = 29). Cho biết tính chất của 2 nguyên tố Y, H (kim loại, phi kim hay khí hiếm). Giải thích?
 Xem đáp án
Xem đáp án
Tính chất của 2 nguyên tố Y, H (kim loại, phi kim hay khí hiếm).
Giải thích. (0,5 điểm)
- Y là phi kim, vì có 6e lớp ngoài cùng.
- H là kim loại vì có 1e lớp ngoài cùng.
Câu 11:
Cho các phân tử sau: KCl, , và .
Biết số hiệu nguyên tử của các nguyên tố lần lượt là: H = 1, N = 7, O = 8, Na = 11, Cl = 17, K = 19.
Viết công thức electron và công thức cấu tạo của các phân tử chứa liên kết cộng hoá trị.
 Xem đáp án
Xem đáp án
Viết CT electron và công thức cấu tạo của phân tử chứa liên kết cộng hoá trị: và (1,0 điểm)
Câu 14:
Hoà tan hoàn toàn 16,5 gam hỗn hợp A gồm Fe và Al vào 500 dung dịch HCl 2,5M (d =1,1g/ml) thu được 13,44 lít (đktc) và dung dịch B. Thực hiện oxi hoá hỗn hợp A với lượng như trên ngoài không khí sau một thời gian thu được hỗn hợp rắn X gồm và . Hoà tan hết hỗn hợp X bằng dung dịch HCl được dùng dư 10% so với lượng cần thiết thu được dung dịch Y. Tính thể tích dung dịch KOH 5M tối thiểu cần cho vào dung dịch Y để thu được lượng kết tủa không đổi
 Xem đáp án
Xem đáp án
Để lượng kết tủa không đổi thì KOH cần tối thiểu là vừa đủ để hoà tan hết . Tổng số mol KOH là: 0,13 + 0,1 + 0,3 + 0,9 + 0,3 = 1,73 mol
Thể tích dung dịch KOH là: 1,73 : 5 = 0,346 lít = 346 ml