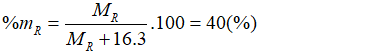Đề thi học kì 1 Hóa học 10 (Đề 3)
-
3488 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Phần trắc nghiệm
Tổng số hạt cơ bản (p, n, e) trong nguyên tử nguyên tố X là 46, biết số hạt mang điện nhiều hơn số hạt không mang điện là 14. Xác định chu kì, số thứ tự ô nguyên tố của X trong bảng tuần hoàn.
 Xem đáp án
Xem đáp án
Chọn D
Gọi số hạt proton, nơtron và electron của X lần lượt là p, n và e.
Theo bài ra ta có: 2p + n = 46 và 2p – n = 14.
Giải hệ phương trình ta được: p = 15 và n = 16.
Vậy X ở ô 15. Cấu hình electron của X là . Vậy X ở chu kỳ 3.
Câu 2:
Tính chất phi kim của các nguyên tố trong dãy N - P - As - Sb - Bi (nhóm VA) biến đổi theo chiều:
 Xem đáp án
Xem đáp án
Chọn D
Trong một nhóm A, theo chiều từ trên xuống dưới (chiều tăng dần của điện tích hạt nhân) tính phi kim của các nguyên tố giảm dần.
Câu 3:
Cho các phân tử . Các phân tử đều có liên kết cộng hóa trị là
 Xem đáp án
Xem đáp án
Chọn D
Phân tử và HCl được cấu tạo nên từ các phi kim do đó liên kết trong phân tử là liên kết cộng hóa trị.
Câu 4:
Nguyên tử của nguyên tố X có cấu hình electron , nguyên tử của nguyên tố Y có cấu hình electron Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
 Xem đáp án
Xem đáp án
Chọn A
X có 1 e lớp ngoài cùng do đó X là kim loại điển hình.
Y có 7 e lớp ngoài cùng do đó Y là phi kim điển hình.
Vậy liên kết giữa nguyên tử X và Y là liên kết ion.
Câu 5:
Cho biết cấu hình electron của nguyên tố A là và cấu hình electron của nguyên tố B là Phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn B
A có 6 e ở lớp ngoài cùng do đó A là phi kim.
B có 1 e ở lớp ngoài cùng do đó B là kim loại.
Câu 6:
Hợp chất của một nguyên tố có công thức . Oxit cao nhất của R chiếm 40% khối lượng R. R là:
 Xem đáp án
Xem đáp án
Chọn C
Oxit cao nhất của R có dạng Theo bài ra có:
→ R = 32. Vậy R là lưu huỳnh (S).
Câu 7:
Cho phương trình phản ứng hóa học sau:
. Trong phản ứng trên chất khử là:
 Xem đáp án
Xem đáp án
Chọn A
Số oxi hóa của Fe tăng từ 0 lên +3 sau phản ứng. Vậy Fe là chất khử.
Câu 9:
Trong các phân tử sau, phân tử có liên kết ba giữa hai nguyên tử là:
 Xem đáp án
Xem đáp án
Chọn D
Ta có CTCT của các chất:
F – F; O = C = O; H – H; N ≡ N.
Vậy chỉ có phân tử chỉ có liên kết ba giữa hai nguyên tử là
Câu 11:
Trong các phản ứng sau, phản ứng nào không phải là phản ứng oxy hóa khử.
 Xem đáp án
Xem đáp án
Chọn D
Phản ứng này không có sự thay đổi số oxi hóa của các nguyên tố sau phản ứng nên không là phản ứng oxi hóa – khử.
Câu 12:
Trong phản ứng hoá học sau: . đóng vai trò là gì?
 Xem đáp án
Xem đáp án
Chọn B
Clo có số oxi hóa tăng từ 0 lên +5 và giảm từ 0 xuống -1 sau phản ứng nên vừa đóng vai trò là chất oxi hóa vừa đóng vai trò là chất khử.