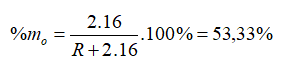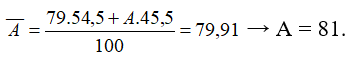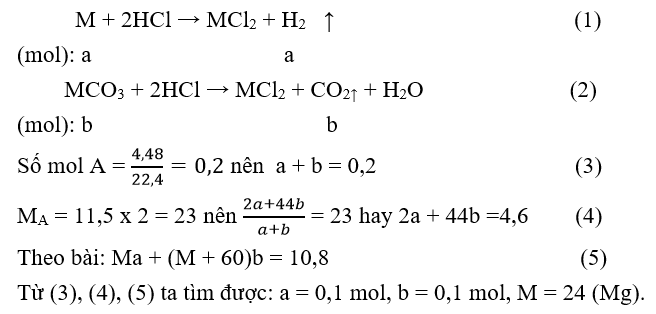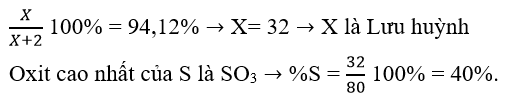Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (Đề 1)
-
3948 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nguyên tử X và Y có hiệu số nguyên tử lần lượt là 19 và 15. Nhận xét nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình electron nguyên tử X là: [Ar] → X có 1electron lớp ngoài cùng, vậy X là kim loại.
Cấu hình electron nguyên tử của Y là: [Ne] → Y có 5electron lớp ngoài cùng, vậy Y là phi kim.
Câu 2:
Sắp xếp các chất sau theo thứ trật tự tính bazơ tăng dần là
 Xem đáp án
Xem đáp án
Đáp án A
Na, Mg và Al thuộc cùng một chu kỳ, . Vậy tính bazơ < NaOH.
Câu 3:
Liên kết trong phân tử Cl2 là
 Xem đáp án
Xem đáp án
Đáp án D
Liên kết hình thành giữa 2 nguyên tử phi kim giống nhau là liên kết cộng hóa trị không phân cực.
Câu 4:
Cho cấu hình electron của các nguyên tử sau:
(X)
(Y)
(Z)
(T)
Dãy các cấu hình electron của các nguyên tử kim loại là
 Xem đáp án
Xem đáp án
Đáp án B
X có 5 electron lớp ngoài cùng nên là phi kim → loại các đáp án A, C và D.
Câu 5:
Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit biến đổi như thế nào?
 Xem đáp án
Xem đáp án
Đáp án D
Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit tăng dần.
Câu 6:
Liên kết trong phân tử KCl là liên kết nào?
 Xem đáp án
Xem đáp án
Đáp án C
Liên kết hình thành giữa kim loại điển hình và phi kim điển hình là liên kết ion.
Câu 7:
Nguyên tố R có Z = 35, vị trí của R trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electtron của R là
R có 4 lớp electron vậy R ở chu kỳ 4.
R có 7 electron lớp ngoài cùng, nguyên tố p, vậy R thuộc nhóm VIIA.
Câu 8:
Chu kỳ là tập hợp các nguyên tố, mà nguyên tử của chúng có cùng?
 Xem đáp án
Xem đáp án
Đáp án C
Các nguyên tố có cùng số lớp electron được xếp thành 1 chu kỳ.
Câu 9:
Trong bảng tuần hoàn các nguyên tố, số chu kỳ nhỏ và chu kì lớn là
 Xem đáp án
Xem đáp án
Đáp án C
Bảng tuần hoàn các nguyên tố hóa học gồm 3 chu kì nhỏ và 4 chu kì lớn.
Câu 10:
Nguyên tố X thuộc chu kỳ 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là?
 Xem đáp án
Xem đáp án
Đáp án B
Số lớp electron của X bằng số thứ tự chu kỳ và bằng 3.
Câu 11:
Hợp chất khí với Hiđro của một nguyên tố là . Oxit cao nhất của nó có chứa 53,33% oxi về khối lượng. Nguyên tố đó là
 Xem đáp án
Xem đáp án
Đáp án B
Hợp chất khí với Hiđro của một nguyên tố là => R có hóa trị IV trong hợp chất khí với H. Hóa trị của R trong hợp chất oxit cao nhất là VIII - IV = IV => Oxit cao nhất là .
→ R = 28
Vậy R là Si (Silic).
Câu 12:
Cho 4,4g hỗn hợp 2 kim loại nhóm IIA thuộc hai chu kỳ liên tiếp với dung dịch HCl dư cho 3,36 lít khí (đktc). Hai kim loại là
 Xem đáp án
Xem đáp án
Đáp án C
Gọi công thức chung 2 kim loại M.
M + 2HCl →
Ta thấy: = 3,36 : 22,4 = 0,15 mol
MM = 4,4 : 0,15 = 29,33.
Có 24 (Mg) < MM < 40 (Ca)
Vậy hai kim loại đó là Mg và Ca.
Câu 13:
Độ âm điện là
 Xem đáp án
Xem đáp án
Đáp án D
Độ âm điện là đại lượng đặc trương cho khả năng hút electron của nguyên tử nguyên tử nguyên tố đó khi hình thành liên kết hóa học.
Câu 14:
Cấu hình electron của nguyên tử nguyên tố X là . Số hiệu nguyên tử của X là?
 Xem đáp án
Xem đáp án
Đáp án C
Số electron của X là 16 → Số hiệu nguyên tử X là 16.
Câu 15:
Nguyên tử khối trung bình của nguyên tố R là 79,91. R có 2 đồng vị. Biết chiếm 54,5%. Nguyên tử khối của đồng vị còn lại có giá trị là
 Xem đáp án
Xem đáp án
Đáp án C
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình:
Câu 16:
Nguyên tố hóa học là gì?
 Xem đáp án
Xem đáp án
Đáp án B
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
Câu 17:
Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
 Xem đáp án
Xem đáp án
Đáp án A
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Trong đó số p = số e.
-Tổng số hạt trong X bằng 40 nên 2p + n = 40 (1)
-Số hạt mang điện (p,e) nhiều hơn số hạt không mang điện (n) là 12 nên 2p –n =12 (2)
- Giải (1) và (2) thu được p =13 và n =14
Số khối A=13+14=27.
Câu 19:
Cation R+ có cấu hình e phân lớp ngoài cùng là 2p6. Liên kết giữa nguyên tử nguyên tố R với oxi thuộc loại liên kết gì?
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình electron của R là [Ne] → R là kim loại điển hình nhóm IA.
Liên kết hình thành giữa R (kim loại điển hình) và Oxi (phi kim điển hình) là liên kết ion.
Câu 20:
Nguyên tử các nguyên tố halogen được sắp xếp theo chiều bán kính nguyên tử giảm dần (từ trái sang phải) là
 Xem đáp án
Xem đáp án
Đáp án D
Chiều giảm dần bán kính nguyên tử: I, Br, Cl, F.
Câu 21:
Phát biểu nào sau đây là không đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Oxit cao nhất của một nguyên tố ở nhóm VIIA luôn có công thức .
Câu 22:
X và Y là hai nguyên tố thuộc hai chu kì liên tiếp nhau và cùng thuộc một nhóm A, trong đó X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 22. Xác định hai nguyên tố X, Y.
 Xem đáp án
Xem đáp án
Đáp án C
Theo đề bài, ta có: = 22 (1)
Nếu X, Y thuộc hai chu kì nhỏ thì (): + 8 (2)
Từ (1) và (2) => =7; = 15.
Vậy X là N, Y là P.
Nếu X thuộc chu kì nhỏ và Y thuộc chu kì lớn thì: = + 18 (3)
Từ (1) và (3) => = 2; = 20 (loại vì không thảo mãn đề bài).
Nếu X, Y thuộc hai chu kì lớn: = + 32 (4)
Từ (1) và (4) => < 0 (loại).
Câu 23:
R thuộc chu kì 3 nhóm VA của bảng tuần hoàn. Cho biết cấu hình electron của R có bao nhiêu electron p?
 Xem đáp án
Xem đáp án
Đáp án C
R thuộc chu kì 3 → Có 3 lớp electron.
R thuộc nhóm VA → Có 5 electron lớp ngoài cùng
→ Cấu hình electron của R: => có 9 e thuộc phân lớp p.
Câu 24:
Biết tổng số electron trong nguyên tử M là 16 electron, cấu hình electron lớp ngoài cùng của M là ns2np4. M thuộc chu kì là
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình e của M là => M có 6 e lớp ngoài cùng.
Tổng số e trong M = 16 = 2+8 + 6 => Cấu hình e của M:
M thuộc chu kì 3.
Câu 25:
Cho biết cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố M (thuộc chu kỳ 4) là . Xác định M
 Xem đáp án
Xem đáp án
Đáp án B
M thuộc chu kì 4 nên có n = 4.
Cấu hình electron M: (ô số 20, nhóm IIA), M là kim loại Ca.
Câu 27:
Cacbon có 2 đồng vị: và . Oxi có 3 đồng vị: , , . Số phân tử CO khác nhau tạo được nên từ các đồng vị trên là
 Xem đáp án
Xem đáp án
Đáp án B
Có 6 phân tử là: ; ; ; ; ; ;
Câu 28:
M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp kim loại và muối cacbonat của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỷ khối của A so với khí hiđro là 11,5. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số mol các chất trong hỗn hợp đầu: M = a mol; = b mol.
Câu 29:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án D
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p
→ Cấu hình electron của X là
→ Z=14 → X là Si.
Câu 30:
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là . Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là
 Xem đáp án
Xem đáp án
Đáp án D
X có cấu hình electron lớp ngoài cùng là → hợp chất khí của X với H là
Trong , X chiếm 94,12% về khối lượng nên ta có