15 câu trắc nghiệm Luyện tập: Liên kết hóa học cực hay có đáp án
-
1685 lượt thi
-
16 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Trog phân tử , số cặp electron (lớp ngoài cùng) chưa tham gia liên kết là
 Xem đáp án
Xem đáp án
Chọn C
Ta có công thức electron của CS2 là ![]()
Vậy trong phân tử CS2 có 4 cặp electron (lớp ngoài cùng) chưa tham gia liên kết.
Câu 2:
Trong các phân tử sau, phân tử nào có nguyên tử trung tâm không có cấu hình electron bền của khí hiếm?
 Xem đáp án
Xem đáp án
Chọn D

Câu 3:
Liên kết hóa học giữa các nguyên tử trong phân tử là liên kết
 Xem đáp án
Xem đáp án
Chọn D
Do oxi có độ âm điện lớn hơn nhiều so với hiđro nên liên kết hóa học giữa các nguyên tử trong phân tử H2O là liên kết cộng hóa trị phân cực.
Hoặc có thể giải thích định tính bằng tính hiệu độ âm điện:
Hiệu độ âm điện của O và H là 3,44 – 2,2 = 1,24. Vậy liên kết hóa học giữa các nguyên tử trong phân tử H2O là liên kết cộng hóa trị phân cực.
Câu 4:
Cho các chất: HBr, HI, HCl. Căn cứ vào hiệu độ âm điện của các nguyên tố, mức độ phân cực của liên kết hóa học trong phân tử các chất này được sắp xếp theo thứ tự giảm dần từ trái sang phải là
 Xem đáp án
Xem đáp án
Chọn C
Độ âm điện của H là 2,2
Từ Cl đến I độ âm điện giảm dần
![]()
Vậy sắp xếp các chất theo thứ tự giảm dần độ phân cực của liên kết là: HCl, HBr, HI.
Câu 5:
Các chất mà phân tử không phân cực là
 Xem đáp án
Xem đáp án
Chọn B
A sai do phân tử H2O phân cực.
C sai do phân tử NH3 phân cực.
D sai do HBr phân cực.
Câu 6:
Cấu hình electron lớp ngoài cùng của nguyên tử Cl (Z=17), Ca (Z=20) và liên kết giữa canxi và clo trong hợp chất lần lượt là
 Xem đáp án
Xem đáp án
Chọn C
Cấu hình electron nguyên tử Cl là [Ne]3s23p5 → Loại B và D
Cấu hình electron nguyên tử Ca là [Ar]4s2 → loại A
Liên kết hình thành giữa Ca (kim loại mạnh) và Cl (phi kim mạnh) trong hợp chất CaCl2 là liên kết ion.
Câu 7:
Hai nguyên tố M và X tạo thành hợp chất có công thức là . Cho biết:
- Tổng số proton trong hợp chất bằng 46.
- Trong hạt nhân của M có n – p = 1, trong hạt nhân của X có n’ = p’.
- Trong hợp chất , nguyên tố X chiếm khối lượng phân tử.
Số hạt proton trong hạt nhân nguyên tử M, X và liên kết trong hợp chất lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
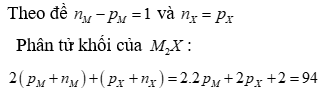
X chiếm 8/47 phần khối lượng => Nguyên tử khối X=16 và M=39
=> Số proton trong X là 8 (oxi), trong M là 19 (kali)
Hợp chất có liên kết ion.
Câu 8:
Cho các nguyên tử X, Y:
- Tổng số các loại hạt cơ bản trong nguyên tử X là 34. Số hạt mang điện nhiều hơn số hạt không mang điện là 10.
- Kí hiệu của nguyên tử Y là .
Công thức hóa học và liên kết trong hợp chất tạo thành từ X và Y là
 Xem đáp án
Xem đáp án
Chọn C
- Xác định X:
Theo bài ra ta có hệ phương trình:
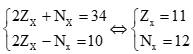
Cấu hình electron của X là: [Ne]3s1 → X là kim loại nhóm IA
X có xu hướng nhường 1e khi hình thành liên kết hóa học:
X → X+ + 1e
- Cấu hình electron của Y là: [He]2s22p5 → Y là phi kim nhóm VIIA hoặc từ kí hiệu nguyên tử xác định Y là Flo.
Y có xu hướng nhận 1e khi hình thành liên kết hóa học:
Y + 1e → Y-
Vậy hợp chất tạo thành là XY; liên kết trong hợp chất là liên kết ion.
Câu 9:
Y, Z là những nguyên tố có số đơn vị điện tích hạt nhân lần lượt là 19, 8. Công thức và liên kết trong hợp chất tạo thành từ Y và Z là
 Xem đáp án
Xem đáp án
Chọn C
Cấu hình electron nguyên tử Y là [Ar]4s1 → Y là kim loại nhóm IA.
→ Y có xu hướng nhường 1 electron khi hình thành liên kết hóa học:
Y → Y+ + 1e
Cấu hình electron nguyên tử Z là [He]2s22p4 → Z là phi kim nhóm VIA
→ Z có xu hướng nhận 2 electron khi hình thành liên kết hóa học:
Z + 2e → Z2-
Vậy hợp chất tạo thành là Y2Z, liên kết trong hợp chất là liên kết ion.
Câu 10:
Một hợp chất có công thức trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n = p và hạt nhân Y có n’ = p’. Tổng số proton trong phân tử là 32. Cấu hình electron của X và Y và liên kết trong phân tử là
 Xem đáp án
Xem đáp án
Chọn A
Y chiếm 50% về khối lượng → MX = 2MY → nX + pX = 2 nY + 2 pY (1)
nX = pX; nY = pY (2)
pX + 2pY = 32 (3)
→ pX = 16 (S): [Ne]3s23p4; pY = 8 (O): [He]2s22p4
Liên kết trong phân tử SO2 là liên kết cộng hóa trị.
Câu 11:
Hạt nhân của nguyên tố X có 20 proton, hạt nhân của nguyên tố Y có 9 proton. Công thức hóa học và liên kết trong phân tử của hợp chất tạo bởi hai nguyên tố này là
 Xem đáp án
Xem đáp án
Chọn B
Cấu hình electron nguyên tử X là: [Ar]4s2 → X là kim loại nhóm IIA
X có xu hướng nhường 2e khi hình thành liên kết hóa học:
X → X2+ + 2e
Cấu hình electron nguyên tử Y là: [He]2s22p5 → Y là phi kim nhóm VIIA
Y có xu hướng nhận 1e khi hình thành liên kết hóa học:
Y + 1e → Y-
Vậy hợp chất tạo thành là XY2, liên kết tạo thành trong hợp chất là liên kết ion.
Câu 12:
Dãy nào trong các chất sau đây gồm các chất được xếp theo chiều giảm dần độ phân cực của liên kết trong phân tử?
 Xem đáp án
Xem đáp án
Chọn B
Dựa vào bảng 6: giá trị độ âm điện của nguyên tử một số nguyên tố nhóm A theo Pau – linh (SGK Hóa 10 – CB trang 45)
Tính được hiệu độ âm điện của các nguyên tố như sau:
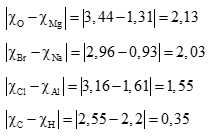
→ Các chất được sắp xếp theo thứ tự chiều giảm dần độ phân cực của liên kết trong phân tử là: CaO, MgO, NaBr, AlCl3, CH4
Câu 13:
Hợp chất tạo bởi các nguyên tử có cấu hình electron ở trạng thái cơ bản là có liên kết thuộc loại
 Xem đáp án
Xem đáp án
Chọn C
Theo bài ra, hợp chất tạo bởi nguyên tử kim loại điển hình (nhóm IA) và phi kim điển hình (nhóm VIIA) nên liên kết trong hợp chất là liên kết ion.
Câu 14:
Cho một số hợp chất: . Dãy các chất trong đó lưu huỳnh có cùng số oxi hóa là
 Xem đáp án
Xem đáp án
Chọn D
![]()
Câu 15:
Phân tử có tổng số các hạt proton, electron, nơtron bằng 196. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 60, số hạt mang điện của X ít hơn số hạt mang điện của Y trong phân tử là 76. Công thức hóa học của là
 Xem đáp án
Xem đáp án
Chọn B
Theo đề bài ra ta có các phương trình.
2pX + nX + 3(2pY + nY) =196 (1)
2pX + 6pY – (nX +3nY ) = 60 (2)
6pY – 2pX = 76 (3)
Từ (1); (2) và (3) giải hệ phương trình được: pY = 17; pX = 13 → AlCl3.
Câu 16:
X, Y là hai nguyên tố thuộc một nhóm A, ở hai chu kì liên tiếp. Cho biết tổng số electron trong anion là 42. Hai nguyên tố X, Y và lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
Loại A vì MgBe3 không phải ion và không có hợp chất MgBe3.
Loại C vì C và O thuộc cùng chu kỳ 2 trong bảng tuần hoàn.
Theo đáp án, xác định ion có dạng:
Theo bài ra, tổng số proton của là 42 – 2 = 40
Hay Zx + 3ZO = 40 hay ZX = 40 – 3.8 = 16. Vậy X là S.
